Avancement
Supposons qu’une transformation chimique est modélisée par la réaction suivante :
Et supposons que les quantités initiales soient :
Que deviennent ces quantités
si la réaction a lieu une fois ?
Si elle a lieu une deuxième fois ?
Et une troisième fois ?
La réaction peut-elle continuer ?
Non
C'est un réactif limitant
Que se serait-il passé avec les quantités suivantes ?
Que dit-on alors du mélange ?
Le mélange est
en proportion stœchiométrique.
Ou plus simplement :
le mélange est stœchiométrique.
Si la réaction est $\ce{a A + b B -> …}$,
quelle relation doit lier les quantités de matière initiales $n_{A}$ et $n_B$ pour que le mélange soit
en proportion stœchiométrique ?
$\displaystyle \frac{n_A}{a}=\frac{n_B}{b}$
Retournons à notre réaction
Mais imaginons maintenant que les quantités initiales soient beaucoup, beaucoup plus grandes. Il faut trouver un moyen plus pratique de tenir les comptes.
Désignons par $x$
le nombre de fois que la réaction a lieu.
On appelle $x$ l'avancement de réaction.
Comment évolue les quantités de matière
des réactifs et des produits en fonction de $x$ ?
Comment se représenter
cette évolution graphiquement ?
Pour faire les comptes, on classe ces infos
dans un tableau : le tableau d’avancement.
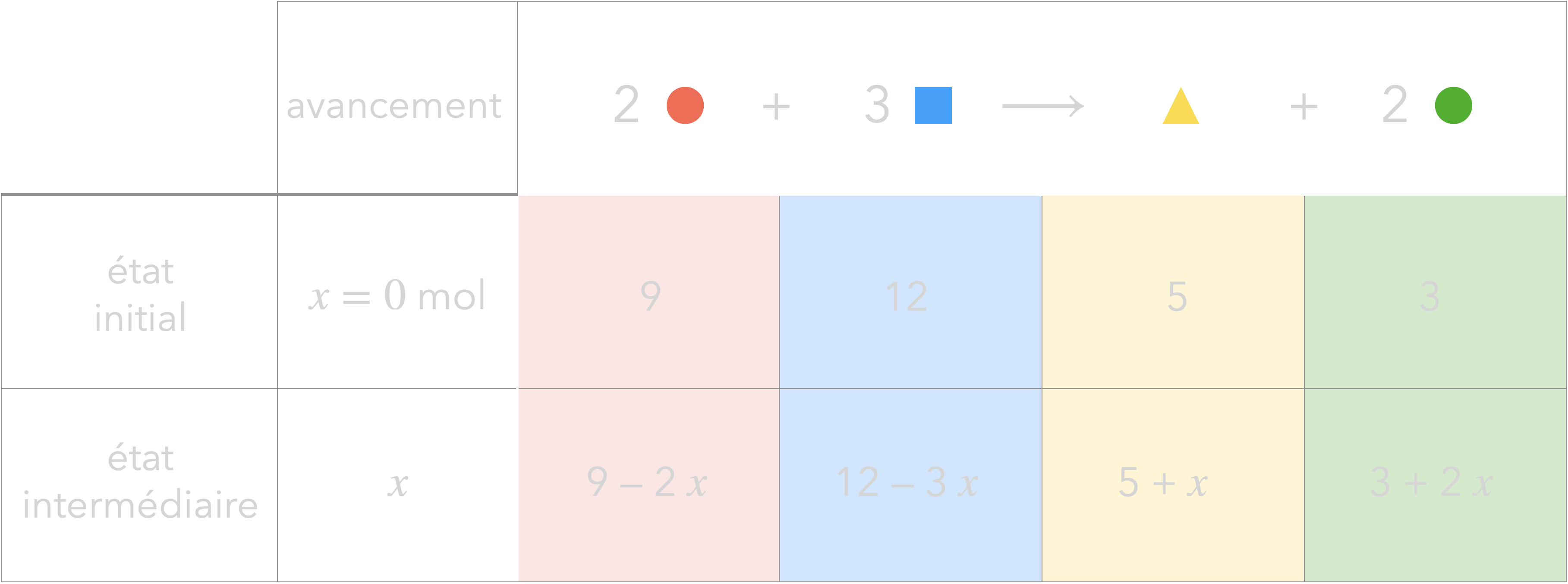
Détermination
de la composition finale
L’avancement en fin de réaction
est appelé avancement final $x_f$.
L’avancement maximal $x_{max}$ est lui l’avancement correspondant à la disparition totale d’un réactif.
Ce réactif est le réactif limitant.
Comme la disparition totale d’un réactif
n’est pas systématique, on a :
S’il y a effectivement disparition totale d’un réactif alors la transformation est dite totale. Et on a :
Si la transformation est totale, alors on peut déterminer $x_{max}$ en supposant tour à tour chacun
des réactifs comme limitant et en en déduisant l’avancement maximal $x_{max}$ correspondant.
L’avancement maximal réel est alors
le plus petit des $x_{max}$ trouvés.
Exemple :

- Si est limitant, alors on a :
$$9-2\, x_{max\color{#FF644E}\Large\bullet} = 0$$$$ \begin{aligned} \Rightarrow x_{max\color{#FF644E}\Large\bullet} &= \frac{\pu{9 mol}}{2}\\ &= \pu{4,5 mol} \end{aligned} $$
- Si est limitant, alors on a :
$$12-3\, x_{max\color{#00A2FF}\small\blacksquare} = 0$$$$ \begin{aligned} \Rightarrow x_{max\color{#00A2FF}\small\blacksquare} &= \frac{\pu{12 mol}}{3}\\ &= \pu{4 mol} \end{aligned} $$
$ \begin{aligned} x_{max} &= \min(x_{max\color{#FF644E}\Large\bullet},x_{max\color{#00A2FF}\small\blacksquare})\\ &= \pu{4 mol} \end{aligned} $
L’état final peut maintenant être ajouté
au tableau d’avancement :
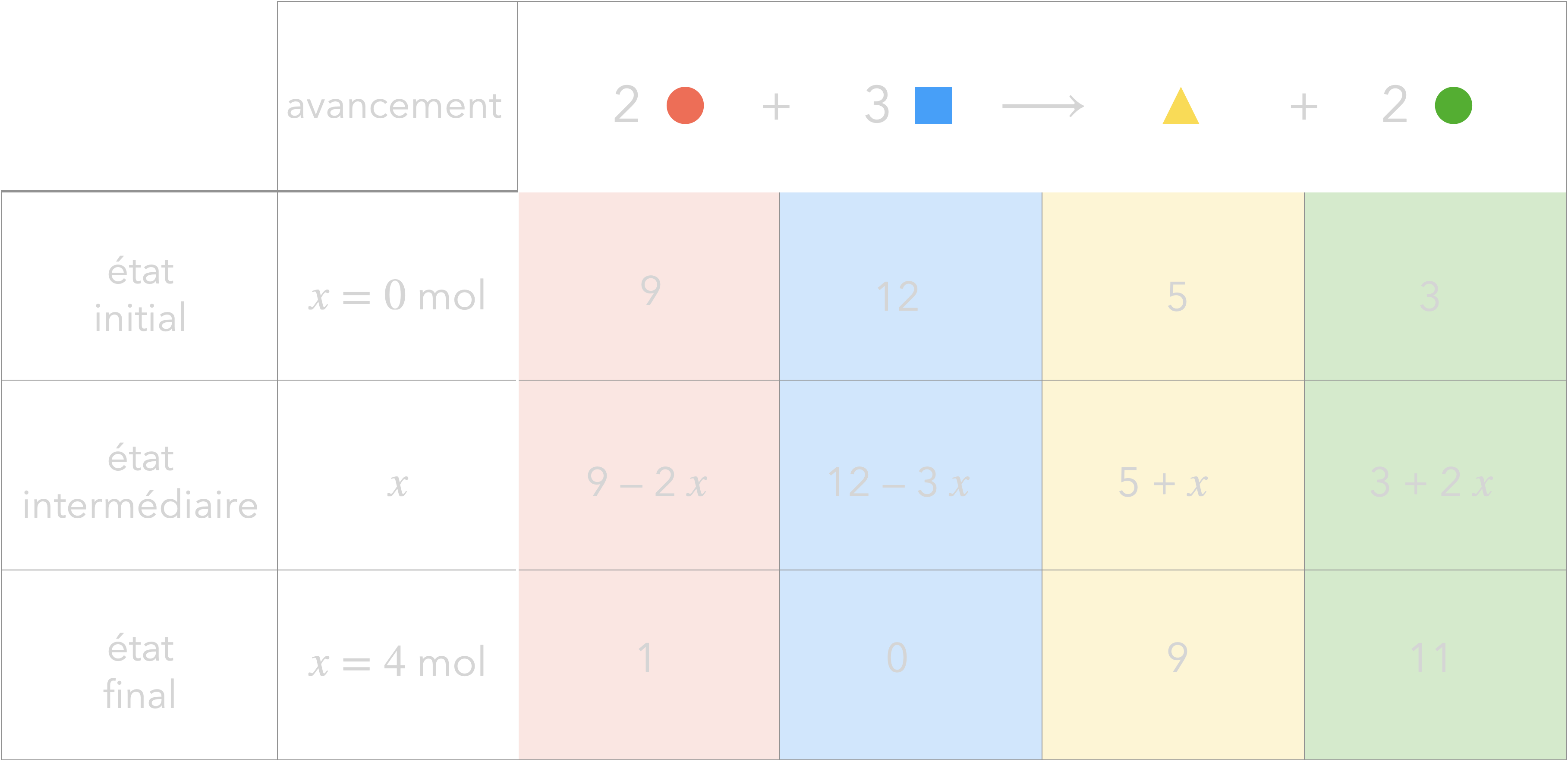
On retrouve bien ce qu’on pouvait déduire
de la représentation graphique.
Autre exemple
Transformation entre le diiode et les ions thiosulfate
Réaction modélisant la transformation étudiée :
Quantités initiales :
- $n_{\ce{I2}\text{,initial}} = n_1 = \pu{4,0E-3 mol} = \pu{4,0 mmol}$
- $n_{\ce{S2O3^2-}\text{,initial}} = n_2 = \pu{5,0E-3 mol} = \pu{5,0 mmol}$
- $n_{\ce{I-}\text{,initial}} = n_3 = \pu{0 mol}$
- $n_{\ce{S4O6^2-}\text{,initial}} = n_4 = \pu{0 mol}$
Dresser un tableau d'avancement.

On supposera la transformation totale.
Déterminer le réactif limitant et l'avancement final.
- Si $\ce{I2}$ est limitant :
$n_1- x_{max1} = 0$$$ \Rightarrow x_{max1} = n_1 = \pu{4,0 mmol}\\ $$ - Si $\ce{S2O3^2-}$ est limitant :
$n_2-2\, x_{max2} = 0$$$ \begin{aligned} \Rightarrow x_{max2} &= \frac{n_2}{2}\\ &= \pu{2,5 mmol} \end{aligned} $$
Comme $x_{max2}<x_{max1}$, $\ce{S2O3^2-}$ est le réactif limitant
et $x_f = x_{max} = \pu{2,5 mmol}$.
Déterminer l'état final.

Deuxième situtation
Quantités initiales :
- $n_{\ce{I2}\text{,initial}} = n_1= \pu{2,0 mmol}$
- $n_{\ce{S2O3^2-}\text{,initial}} = n_2 = \pu{5,0 mmol}$
- $n_{\ce{I-}\text{,initial}} = n_3 = \pu{0 mol}$
- $n_{\ce{S4O6^2-}\text{,initial}} = n_4 = \pu{0 mol}$
Dresser un tableau d'avancement.

On supposera la transformation totale.
Déterminer le réactif limitant et l'avancement final.
- Si $\ce{I2}$ est limitant :
$n_1- x_{max1} = 0$$$ \Rightarrow x_{max1} = n_1 = \pu{2,0 mmol}\\ $$ - Si $\ce{S2O3^2-}$ est limitant :
$n_2-2\, x_{max2} = 0$$$ \begin{aligned} \Rightarrow x_{max2} &= \frac{n_2}{2}\\ &= \pu{2,5 mmol} \end{aligned} $$
Comme $x_{max1}<x_{max2}$, $\ce{I2}$ est le réactif limitant
et $x_f = x_{max} = \pu{2,0 mmol}$.
Déterminer l'état final.

Troisième situtation
Quantités initiales :
- $n_{\ce{I2}\text{,initial}} = n_1= \pu{2,5 mmol}$
- $n_{\ce{S2O3^2-}\text{,initial}} = n_2 = \pu{5,0 mmol}$
- $n_{\ce{I-}\text{,initial}} = n_3 = \pu{0 mol}$
- $n_{\ce{S4O6^2-}\text{,initial}} = n_4 = \pu{0 mol}$
Dresser un tableau d'avancement.

On supposera la transformation totale.
Déterminer le réactif limitant et l'avancement final.
- Si $\ce{I2}$ est limitant :
$n_1- x_{max1} = 0$$$ \Rightarrow x_{max1} = n_1 = \pu{2,5 mmol}\\ $$ - Si $\ce{S2O3^2-}$ est limitant :
$n_2-2\, x_{max2} = 0$$$ \begin{aligned} \Rightarrow x_{max2} &= \frac{n_2}{2}\\ &= \pu{2,5 mmol} \end{aligned} $$
Comme $x_{max1}=x_{max2}$,
les deux réactifs sont limitants en même temps.
Le mélange est stœchiométrique.
Et $x_f = x_{max} = \pu{2,5 mmol}$.
Déterminer l'état final.

Quatrième situation
Quantités initiales :
- $n_{\ce{I2}\text{,initial}} = n_1= \pu{2,5 mmol}$
- $n_{\ce{S2O3^2-}\text{,initial}} = n_2 = \pu{5,0 mmol}$
- $n_{\ce{I-}\text{,initial}} = n_3 = \pu{0 mol}$
- $n_{\ce{S4O6^2-}\text{,initial}} = n_4 = \pu{2,0 mol}$
Qu'est-ce qui change ?
Quel est le nouvel état final ?

Outil informatique
A : mol
B : mol
C : mol
D : mol
Tableau d’avancement de la réaction :
Petit programme Python réalisant la même chose :
Initialisation des variables
import matplotlib.pyplot as plt
# coefficients stœchiométrique
# aA A + aB B -> aC C + aD D
aA = 2
aB = 3
aC = 1
aD = 2
# quantités initiales
nA = 0.02
nB = 0.04
nC = 0.01
nD = 0
x = 0 # Initialisation de l'avancement
dx = 0.001 # Incrément d'avancement
X = [x] # Liste stockant les valeurs successives d'avancement
NA = [nA] # Liste stockant les quantités des matières du réactif A
NB = [nB] # Idem pour le réactif B
NC = [nC] # Idem pour le produit C
ND = [nD] # Idem pour le produit D
cœur du programme :
while NA[-1] > 0 and NB[-1] > 0:
x = x + dx
X.append(x)
NA.append(nA - aA * x)
NB.append(nB - aB * x)
NC.append(nC + aC * x)
ND.append(nD + aD * x)
tracés
plt.figure(figsize=(15,10),dpi=150)
plt.plot(X, NA, 'r-', lw=1, label='nA')
plt.plot(X, NB, 'g-', lw=1, label='nB')
plt.plot(X, NC, 'b-', lw=1, label='nC')
plt.plot(X, ND, 'y-', lw=1, label='nD')
plt.grid(True)
plt.xlabel('x (mol)')
plt.ylabel('n (mol)')
plt.legend()
plt.show()
Question subsidiaire :
Établir le tableau d’avancement
auquel correspond ce graphe.