Cohésion dans un solide
Dans un solide ou un liquide, les entités sont liées
entre elles par la force électrostatique qui attire
l’une à l’autre des charges de signes opposés.
Interactions entre ions
Au vu de ces schémas,
comment peut-on expliquer
la cohésion d’un solide ionique ?
Interactions entre molécules
polaires ou polarisables
Comment maintenant expliquer la cohésion de solides moléculaires (comme le sucre) où les entités
sont électriquement neutres ?
Grâce aux interactions entre dipôles électrostatiques !
On appelle ces interactions
interactions de Van der Waals.
Lorsque les molécules sont polaires, elles forment un petit dipôle électrostatique et, comme les ions,
ces dipôles peuvent être disposés de manière
à interagir globalement attractivement.
D’accord, mais comment expliquer la cohésion
de solides ou liquides moléculaires
comme le diiode ou le dibrome ?
Le nuage électronique d’une molécule apolaire fluctue en permanence et crée sans arrêt des asymétries
de la répartition des charges.
Une molécule apolaire n'est ainsi en réalité
jamais instantanément apolaire.
Elle ne l'est qu'en moyenne.
Pendant chaque court laps de temps où la molécule
a une polarité donnée, elle peut induire par influence une polarisation identique des molécules voisines
et des interactions entre dipôles se font alors jour comme précédemment.
Ces interactions entre molécules apolaires sont un peu moins énergétiques que les interactions entre molécules polaires (et seront d’autant plus importantes que la molécule est grosse et donc polarisable).
Et les interactions entre dipoles sont elles-mêmes
beaucoup plus faibles que les interactions entre ions.
Quelle grandeur caractéristique
d’un solide permettrait de vérifier
cette hiérarchie entre les interactions ?
La température de fusion du solide.
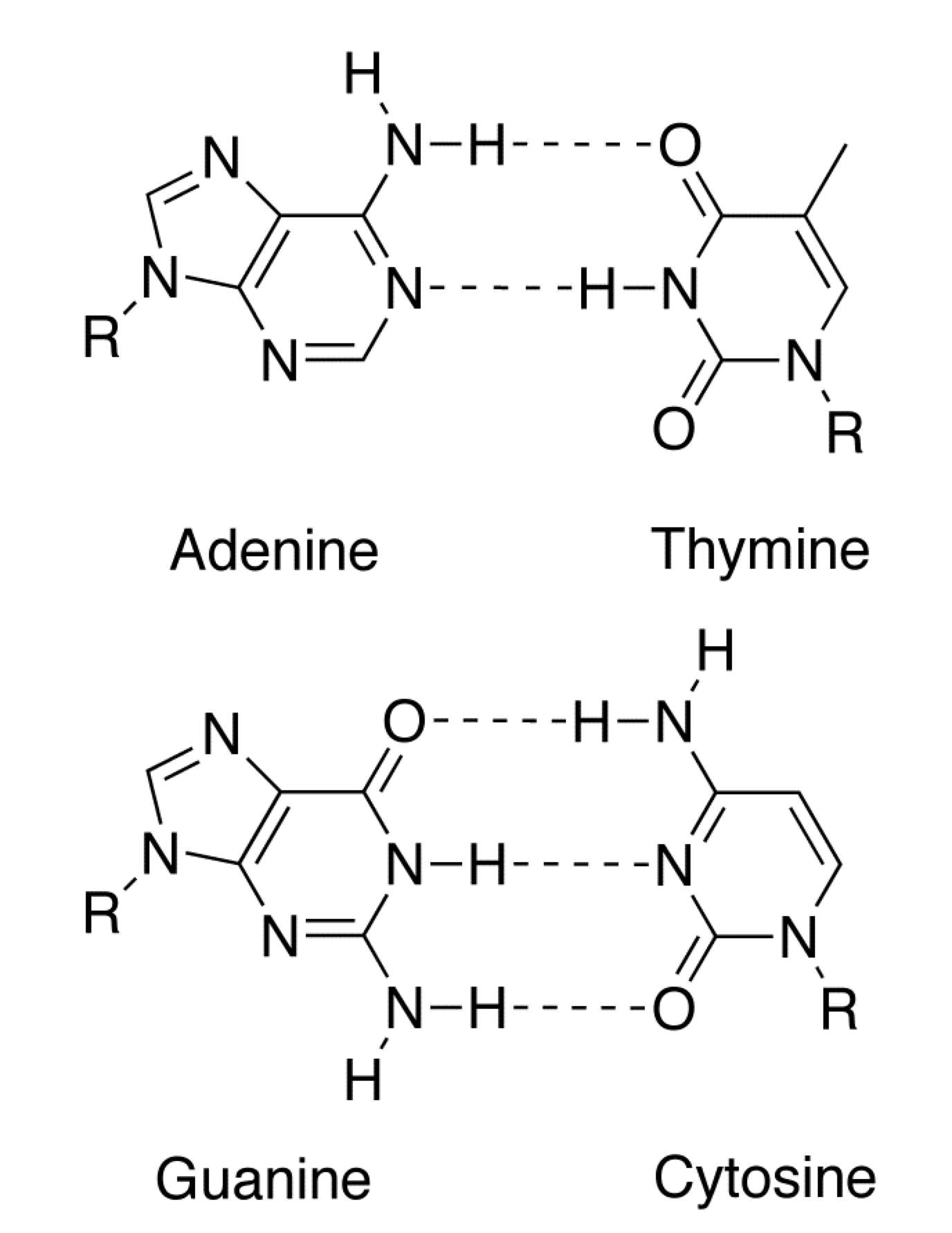
Ponts hydrogène
Une interaction dipolaire plus forte que les autres a lieu lorsqu’un hydrogène $\ce{H}$ est lié dans une molécule
à un atome fortement électronégatif
(comme $\color{#FF968D}\ce{O}$, $\color{#FF968D}\ce{N}$, $\color{#FF968D}\ce{F}$, $\color{#FF968D}\ce{Cl}$ ou $\color{#FF968D}\ce{S}$).
L'interaction se fait entre un de ces $\ce{H}$
sur une molécule et un élément électronégatif
sur une autre molécule.
On représente ces ponts hydrogène
par des pointillés.
La cohésion entre les deux brins d’ADN est due aux ponts hydrogène entre bases complémentaires.
Les ponts hydrogène sont aussi le plus souvent responsables de la structure secondaire des protéines (hélices α et feuillets β).
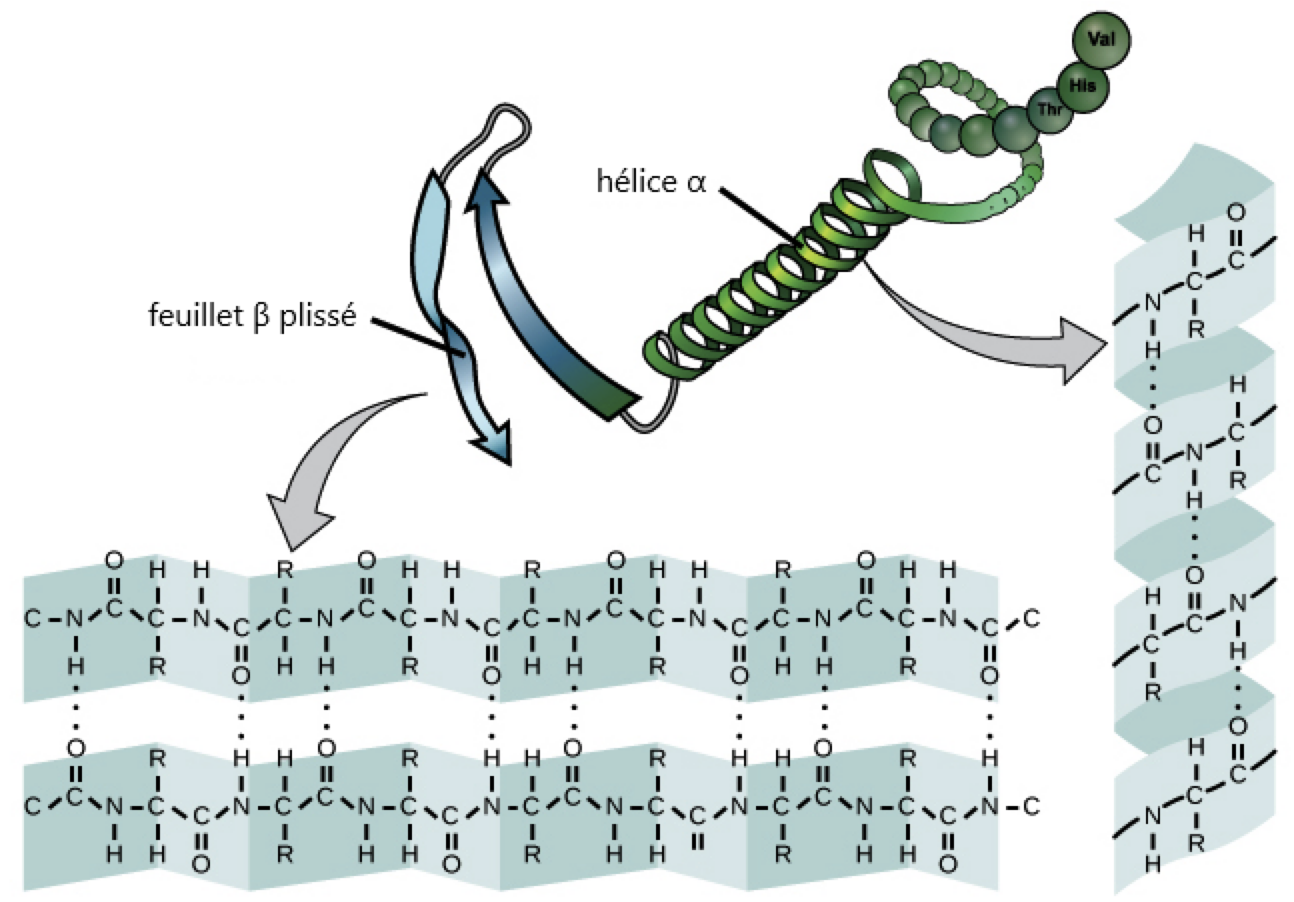
C’est la force de cette interaction
qui explique la grande cohésion de l’eau !
Représentez les ponts hydrogène
entre molécules d'eau.
Dissolution
La dissolution d’un solide ionique dans un solvant polaire comme l’eau s’explique par l’interaction entre les molécules du solvant polaire et les ions du solide.
Elle se modélise en 3 étapes :
- dissociation du solide ionique : les molécules du solvant amoindrissent les interactions entre les ions qui se séparent.
- solvatation des espèces ioniques : les ions se retrouvent entourés par les molécules du solvant.
On dit qu'ils sont solvatés (ou hydratés dans le cas de l'eau). - dispersion : les ions solvatés se dispersent au milieu des molécules de solvant.
L’équation de la dissolution d’un solide ionique $\ce{A_\alpha B_\beta} (s)$ dans l’eau est :
L’électroneutralité du solide
se conserve dans la solution.
Quelle relation doit-il exister entre $\alpha$, $\beta$, $i$ et $j$ ?
$$\alpha\times i = \beta\times j$$
Que vaut la concentration des ions dans la solution apportée en supposant qu’on a dissous $n$ mol du solide ionique dans un volume final de solution $V$ ?
Si on suppose la dissolution totale, on peut
dresser le petit tableau d’avancement suivant :
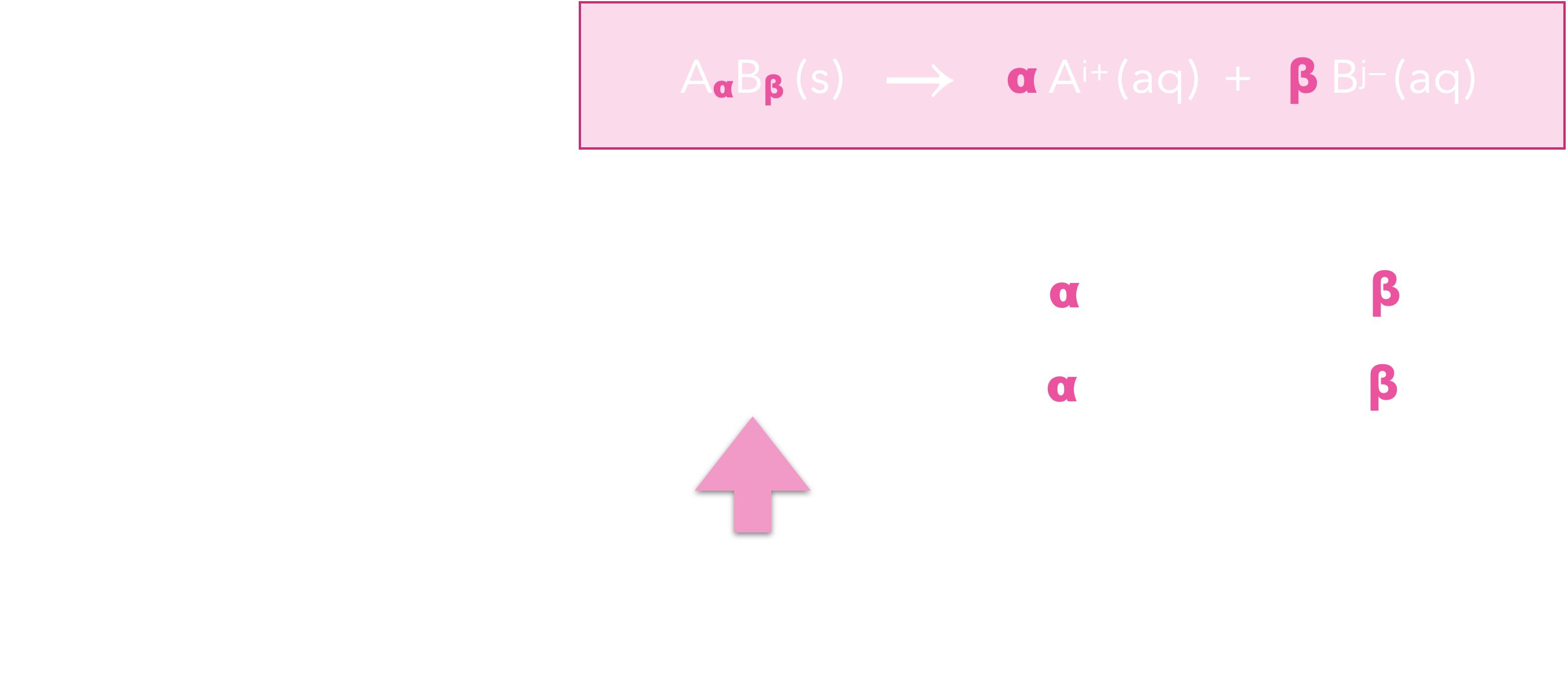
On en déduit :
- $\ce{[A^i+]}=$ $\displaystyle \frac{\alpha n}{V}$
- $\ce{[B^j-]}=$ $\displaystyle \frac{\beta n}{V}$
Exemple :
On réalise par dissolution d’une quantité de matière $n=\pu{ 3,5 mmol}$ de chlorure de cuivre II $\ce{CuCl2} (s)$ dans de l’eau distillée une solution d’un volume $V=\pu{ 70 mL}$.
Que vallent les concentrations en ions cuivre II
et en ions chlorure dans la solution ?
$$\ce{CuCl2 (s) -> Cu^2+ (aq) + 2 Cl- (aq)}$$
Tableau d’avancement
(en supposant la dissolution totale) :
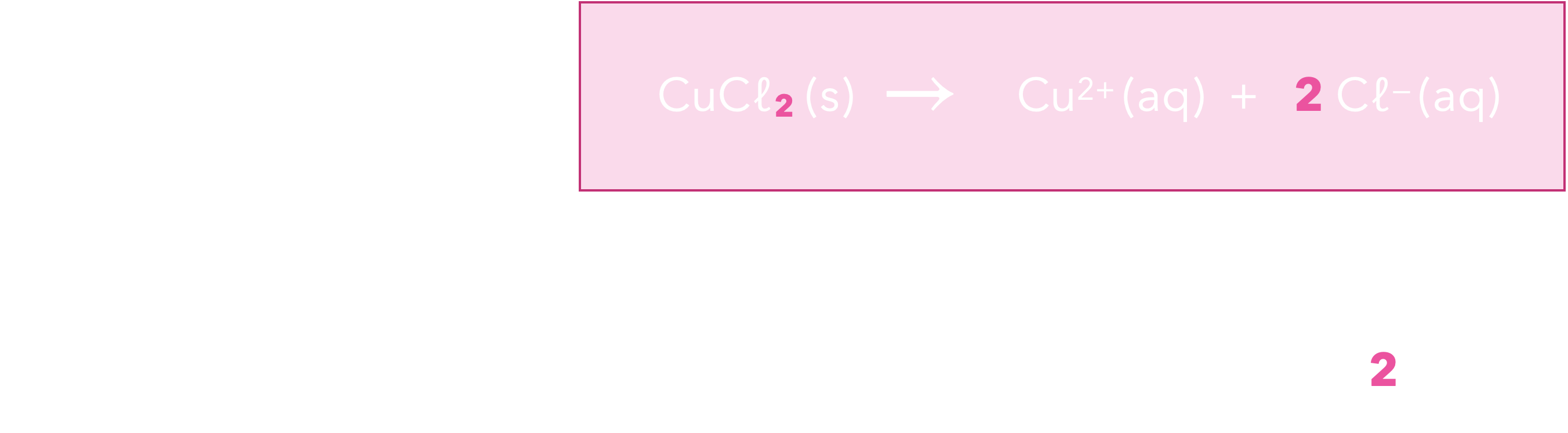
On en déduit :
$$ \begin{aligned} \ce{[Cu^2+]} &= \displaystyle \frac{n}{V}\\ &= \frac{\pu{3,5 mmol}}{\pu{70 mL}} \\ &= \pu{5,0E-2 mol*L-1} \end{aligned} $$
et :
$$ \begin{aligned} \ce{[Cl^-]} &= \displaystyle \frac{2n}{V}\\ &= \frac{\pu{2\times 3,5 mmol}}{\pu{70 mL}} \\ &= \pu{1,0E-1 mol*L-1} \end{aligned} $$
Solubilité et miscibilité
Extraction par solvant
La solubilité mesure la capacité d’un solvant
à solubiliser une espèce chimique.
Elle dépend de la température,
et de la nature du solvant.
Si un soluté ne se dissout pas du tout
dans un solvant, il est dit insoluble dans ce solvant.
- Un soluté polaire ou ionique se dissout
mieux dans un solvant polaire. - Un soluté apolaire se dissout mieux
dans un solvant apolaire.
Expérience 1 :
On mélange des cristaux de diiode ($\ce {I2 (s)}$),
de l’eau ($\ce {H2O (ℓ)}$), et de l’hexane ($\ce {C6H14 (ℓ)}$).
On remplace les cristaux de diiode
par du sulfate de cuivre ($\ce{CuSO4 (s)}$).
Qu'observe-t-on après repos
pour chacune des expériences ?
Données :
- l'hexane et l'eau sont non miscibles.
- densité de l'hexane : 0,661.
Deux liquides sont miscibles s’ils peuvent
former un mélange homogène.
On peut exploiter les différences de solubilité
d’un solvant à l’autre et la miscibilité ou non
entre deux solvants afin d’extraire un soluté.
C'est l'extraction par solvant
ou extraction liquide-liquide.
Supposons qu’un soluté soit présent dans un solvant A.
le soluté est plus soluble et qui est
non miscible avec le solvant A.
La pièce de verrerie utilisée pour une extraction
par solvant est l’ampoule à décanter.
Protocole :
Points délicats du protocole :
- Étape 2 : le dégazage permet d'évacuer
la surpression due à la volatilité importante
de certains solvants organiques qui est augmentée
par l'agitation.
⚠️⚠️⚠️
Ce dégazage doit toujours se faire vers un mur
car des projections de liquide sont possibles.
💀💀💀
⚠️⚠️⚠️
Et il faut veiller aussi à maintenir fermement
le bouchon en place avec sa main
pour éviter qu'il ne saute.
💀💀💀
- Étape 4 : lors de l'étape de récupération du solvant d'intérêt après décantation, il convient :
- d'arrêter le versement dans le bécher avant
la première goutte du solvant qui surnage
si le soluté est dans le solvant le plus dense ; - d'arrêter le versement dans le bécher après
les premières gouttes du solvant qui surnage
si le soluté est dans le solvant le moins dense.
- d'arrêter le versement dans le bécher avant
Savon
Les détergents capables d’enlever les salissures sont des composés tensioactifs (capables de réduire la tension superficielle entre deux surfaces
permettant ainsi leur mélange).
Ils sont constitués de molécules
organiques amphiphiles.
Elles présentent deux parties de polarité différente, une queue lipophile et hydrophobe apolaire (qui “aime” les matières grasses), et une tête polaire hydrophile
et lipophobe (qui “aime” l’eau).
Molécule de savon