Expérience de l’horloge à iode
Solution A
-
On dilue une solution commerciale de peroxyde d’hydrogène (eau oxygénée) à 110 volumes en utilisant une pipette jaugée de 16,0 mL et une fiole jaugée de 100 mL. On obtient la solution A1.
-
La solution A est obtenue en prélevant 15 mL de A1 auxquels on ajoute une pointe de thiodène (amidon + urée qui forme un complexe bleu intense avec le diiode).
- Quelle est la concentration en peroxyde d’hydrogène ($\ce{H2O2}$) de la solution commerciale ?
Solution commerciale à 110 volumes $\rightarrow$ 1 L de solution libère $V_{\ce{O2}}=\pu{110 L}$ de dioxygène.
$$ \begin{aligned} \Rightarrow n_\ce{O2}&= \frac{V_\ce{O2}}{V_m}\\ &=\frac{\pu{110 L}}{\pu{24 L}}\\ &=\pu{4,6 mol} \end{aligned} $$
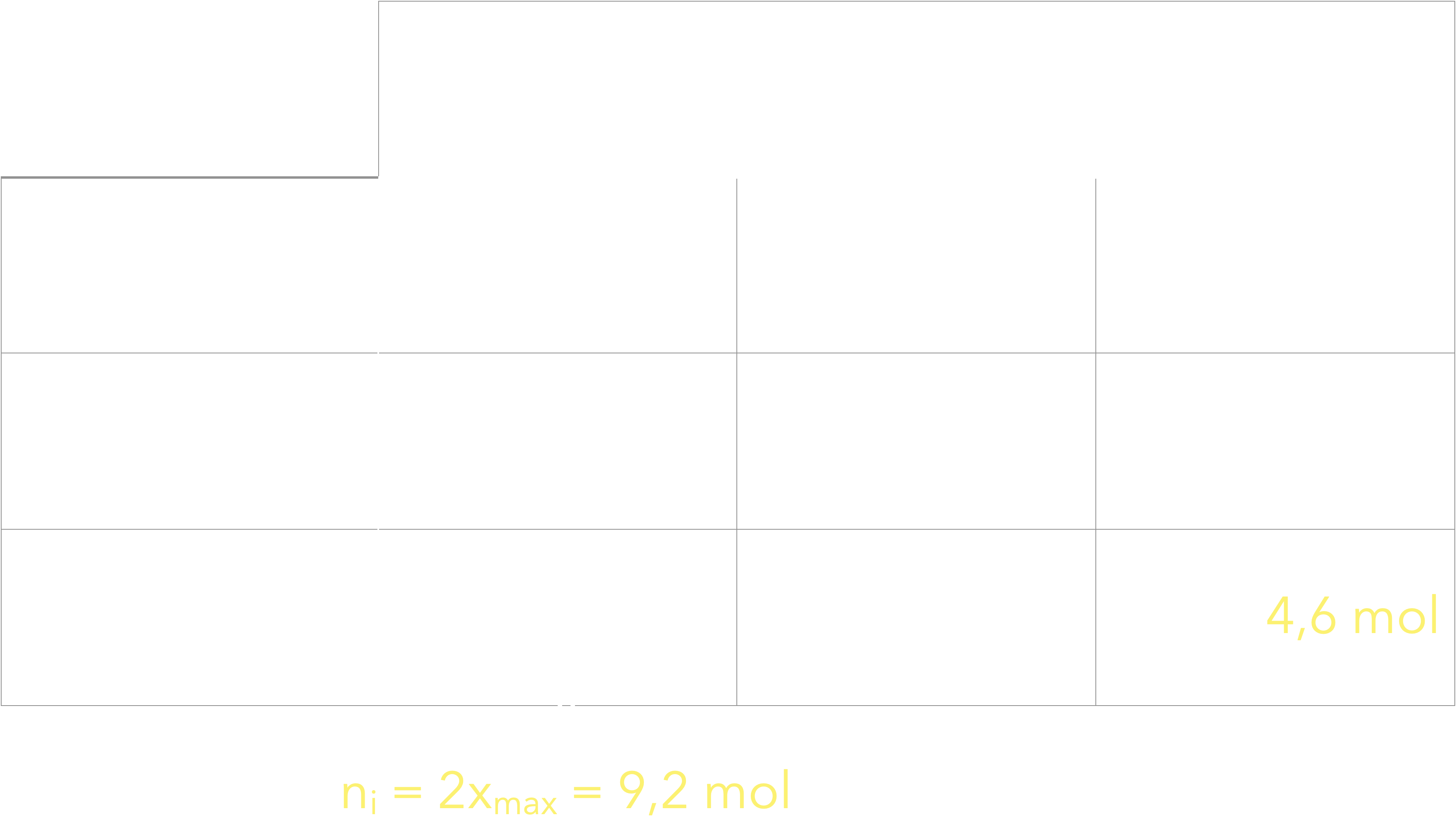
Pour une solution commerciale d’un volume $V=\pu{1 L}$,
la concentration est donc :
$$C=\frac{n_i}{V}=\pu{9,2 mol*L-1}$$
- Quelle est la concentration obtenue après dilution ?
lors d'une dilution :
$$ \begin{aligned} n_\text{fille}&= n_\text{mère}\\ C_\text{fille}\times V_\text{fille}&=C_\text{mère}\times V_\text{mère}\\ \Rightarrow C_\text{fille} &= C_\text{mère}\times\frac{V_\text{mère}}{V_\text{fille}}\\ &= (\pu{9,2 mol*L-1})\times\frac{\pu{16 mL}}{\pu{100 mL}}\\ &=\pu{1,5 mol*L-1} \end{aligned} $$
- Quelle est la quantité de matière $n_A$
en $\ce{H2O2}$ dans la solution A ?
$$ \begin{aligned} n_A &= C_\text{fille}\times V\\ & = (\pu{1,5 mol*L-1})\times(\pu{15e-3 L})\\ &= \pu{2,3e-2 mol} \end{aligned} $$
Solution B
- En diluant 20 fois une solution de bétadine, on obtient une solution B1 de concentration en diiode $C_{B1}=\pu{2,1e-3 mol*L-1}$.
- Quelle est la quantité de matière $n_{B1}$ de diiode contenue dans $V_{B1}=\pu{10 mL}$ de la solution B1 ?
$$ \begin{aligned} n_{B_1} &= C_{B_1}\times V_{B_1}\\ & = (\pu{2,1e-3 mol*L-1})\times(\pu{10e-3 L})\\ &= \pu{2,1e-5 mol} \end{aligned} $$
- On broie 8,80 g de cachets de vitamine C pure (de formule brute $\ce{C6H8O6}$) puis on les dissout en utilisant une fiole jaugée de 250 mL pour obtenir la solution B2.
- Quelle est la quantité de matière $n_{B2}$ de vitamine C contenue dans $V_{B2}=\pu{3,0 mL}$ de la solution B2 ?
Quantité de matière dissoute :
$$ \begin{aligned} n &= \frac{m}{M(\ce{C6H8O6})}\\ &= \frac{\pu{8,80 g}}{\pu{176 g*mol-1}}\\ &= \pu{5,00e-2 mol} \end{aligned} $$
Concentration de la solution obtenue
après dissolution :
$$ \begin{aligned} C_{B_2} &= \frac{n}{V}\\ &= \frac{\pu{5,00e-2 mol}}{\pu{250e-3 L}}\\ &= \pu{0,200 mol*L-1} \end{aligned} $$
Quantité de matière prélevée :
$$ \begin{aligned} n_{B_2} &= C_{B_2}\times V_{B_2}\\ & = (\pu{0,200 mol*L-1})\times(\pu{3,0e-3 L})\\ &= \pu{6,0e-4 mol} \end{aligned} $$
- On prépare la solution B en ajoutant 3,0 mL de B2 à 10 mL de B1.
- Écrire la réaction d’oxydoréduction
entre le diiode ($\ce{I2}$) et la vitamine C ($\ce{C6H8O6}$).
Les couples sont :
$(\ce{I2}/\ce{I-})$
$(\ce{C6H6O6}/\ce{C6H8O6})$
- Tracer un tableau d’avancement et déterminer l’état final de la réaction entre le diiode et la vitamine C en la supposant totale.
On verse le contenu du bécher B dans le bécher A.
Il y a alors réaction d’oxydoréduction entre le peroxyde d’hydrogène et les ions iodures.
- Écrire la réaction.
Les couples sont :
$(\ce{H2O2}/\ce{H2O})$
$(\ce{I2}/\ce{I-})$
- Le $\ce{H2O2}$ est-il limitant ?
- Comment expliquer alors que la solution ne se colore pas instantanément.