Lewis et polarité
Schéma de Lewis
Les éléments cherchent à acquérir la structure électronique plus stable d’un gaz noble.
Pour cela ils peuvent :
- perdre ou gagner des électrons
et former ainsi des ions. - mettre en commun un ou plusieurs électrons avec d'autres éléments dans des liaisons covalentes (chaque liaison ajoute un électron à la structure électronique). Ils forment alors des molécules.
Le schéma de Lewis d’une molécule permet de visualiser les électrons de valence des éléments.
Un doublet d'électrons est représenté par un tiret.
- Il peut s'agir soit d'un doublet liant qui relie deux éléments différents (une liaison covalente),
- soit d'un doublet non-liant qui représente des électrons de valence ne participant pas à une liaison.
Pour être le plus stable possible, un élément doit s’entourer de 4 doublets (liants ou non-liants) car la configuration électronique de la couche de valence des gaz nobles est ns2np6 et comporte donc 8 électrons.
Si l'élément est bien entouré de 4 doublets,
on dit qu'il respecte la règle de l'octet.
Exception :
l’Hydrogène cherche, lui, à ressembler à l’Hélium de configuration 1s2. Il ne lui manque qu’un électron
et il va donc former une liaison.
Dans une molécule, un Hydrogène est donc
toujours entouré d'un unique doublet liant.
On dit dans ce cas que l'Hydrogène
respecte la règle du duet.
Donner les schémas de Lewis
des molécules de formule brute suivante :
Si un élément autre que l’hydrogène est entouré de moins de 4 doublets, alors on complète pour arriver à 4 par des lacunes électroniques.
On parle alors d’acide de Lewis.
Charges formelles et ions
La charge formelle $q$ d’un élément vaut :
où
- ${\color{#FFF}n_v} $ est le nombre d'électrons de valence de l'atome,
- $\color{#FFF056}n_{l}$ est le nombre de doublets liants,
- $\color{#56C1FF}n_{nl}$ est le nombre de doublets non liants.
Si un élément isolé possède une charge formelle,
il s’agit d’un ion monoatomique.
Dans un édifice polyatomique, si les différentes charges formelles des éléments ne s'annulent pas,
il s'agit d'un ion polyatomique.
Exemples :
Pour l’atome d’Hydrogène : ${\color{#FFF}n_v} =$ ${\,\color{#FFF}1}$
Ici : ${\color{#FFF056}n_{l}} = $${\,\color{#FFF056}0}$ et ${\color{#56C1FF}n_{nl}} =$ $\,{\color{#56C1FF}0}$
$\Rightarrow$ Charge formelle : $q = {\color{#FFF}1}-{\color{#FFF056}0}-{\color{#56C1FF}0}\times 2 = +1$
On obtient l'ion hydrogène $\ce{H+}$.
Pour l’atome de Sodium : ${\color{#FFF}n_v} =$ ${\,\color{#FFF}1}$
Ici : ${\color{#FFF056}n_{l}} = $${\,\color{#FFF056}0}$ et ${\color{#56C1FF}n_{nl}} =$ $\,{\color{#56C1FF}0}$
$\Rightarrow$ Charge formelle : $q = {\color{#FFF}1}-{\color{#FFF056}0}-{\color{#56C1FF}0}\times 2 = +1$
On obtient l'ion sodium $\ce{Na+}$.
Pour l'atome de Chlore : ${\color{#FFF}n_v} = {\color{#FFF}7}$.
Ici : ${\color{#FFF056}n_{l}} = {\color{#FFF056}0}$ et ${\color{#56C1FF}n_{nl}} = {\color{#56C1FF}4}$.
$\Rightarrow$ Charge formelle : $q = {\color{#FFF}7}-{\color{#FFF056}0}-{\color{#56C1FF}4}\times 2 = -1$.
On obtient l'ion chlorure $\ce{Cl-}$.
Pour l'atome d'Oxygène : ${\color{#FFF}n_v} = {\color{#FFF}6}$.
Ici ${\color{#FFF056}n_{l}} = {\color{#FFF056}0}$ et ${\color{#56C1FF}n_{nl}} = {\color{#56C1FF}4}$.
$\Rightarrow$ Charge formelle : $q = {\color{#FFF}6}-{\color{#FFF056}0}-{\color{#56C1FF}4}\times 2 = -2$.
On obtient l'ion oxyde $\ce{O^2-}$.
Pour l'atome d'Azote : ${\color{#FFF}n_v} = {\color{#FFF}5}$.
Ici : ${\color{#FFF056}n_{l}} = {\color{#FFF056}4}$ et ${\color{#56C1FF}n_{nl}} = {\color{#56C1FF}0}$.
$\Rightarrow$ Charge formelle : $q = {\color{#FFF}5}-{\color{#FFF056}4}-{\color{#56C1FF}0}\times 2 = +1$.
On obtient l'ion ammonium $\ce{NH4+}$.
Pour l'atome d'Oxygène : ${\color{#FFF}n_v} = {\color{#FFF}6}$.
Ici : ${\color{#FFF056}n_{l}} = {\color{#FFF056}3}$ et ${\color{#56C1FF}n_{nl}} = {\color{#56C1FF}1}$.
$\Rightarrow$ Charge formelle : $q = {\color{#FFF}6}-{\color{#FFF056}3}-{\color{#56C1FF}1}\times 2 = +1$.
On obtient l'ion oxonium $\ce{H3O+}$.
Pour l'atome d'Oxygène : ${\color{#FFF}n_v} = {\color{#FFF}6}$.
Ici : ${\color{#FFF056}n_{l}} = {\color{#FFF056}1}$ et ${\color{#56C1FF}n_{nl}} = {\color{#56C1FF}3}$.
$\Rightarrow$ Charge formelle : $q = {\color{#FFF}6}-{\color{#FFF056}1}-{\color{#56C1FF}3}\times 2 = -1$.
On obtient l'ion hydroxyde $\ce{OH-}$.
- Déterminer les charges formelles
de chaque élément. - S’agit-il d’un ion polyatomique ?
Géométrie
Un élément est le plus souvent entouré de 4 doublets. Or ces électrons se repoussent électrostatiquement !
Résultat, les 4 doublets (liants ou non liants) se répartissent spatialement pour former un tétraèdre.
En fonction de la nature liante ou non liante des doublets, on va pouvoir en déduire la géométrie possibles des molécules.
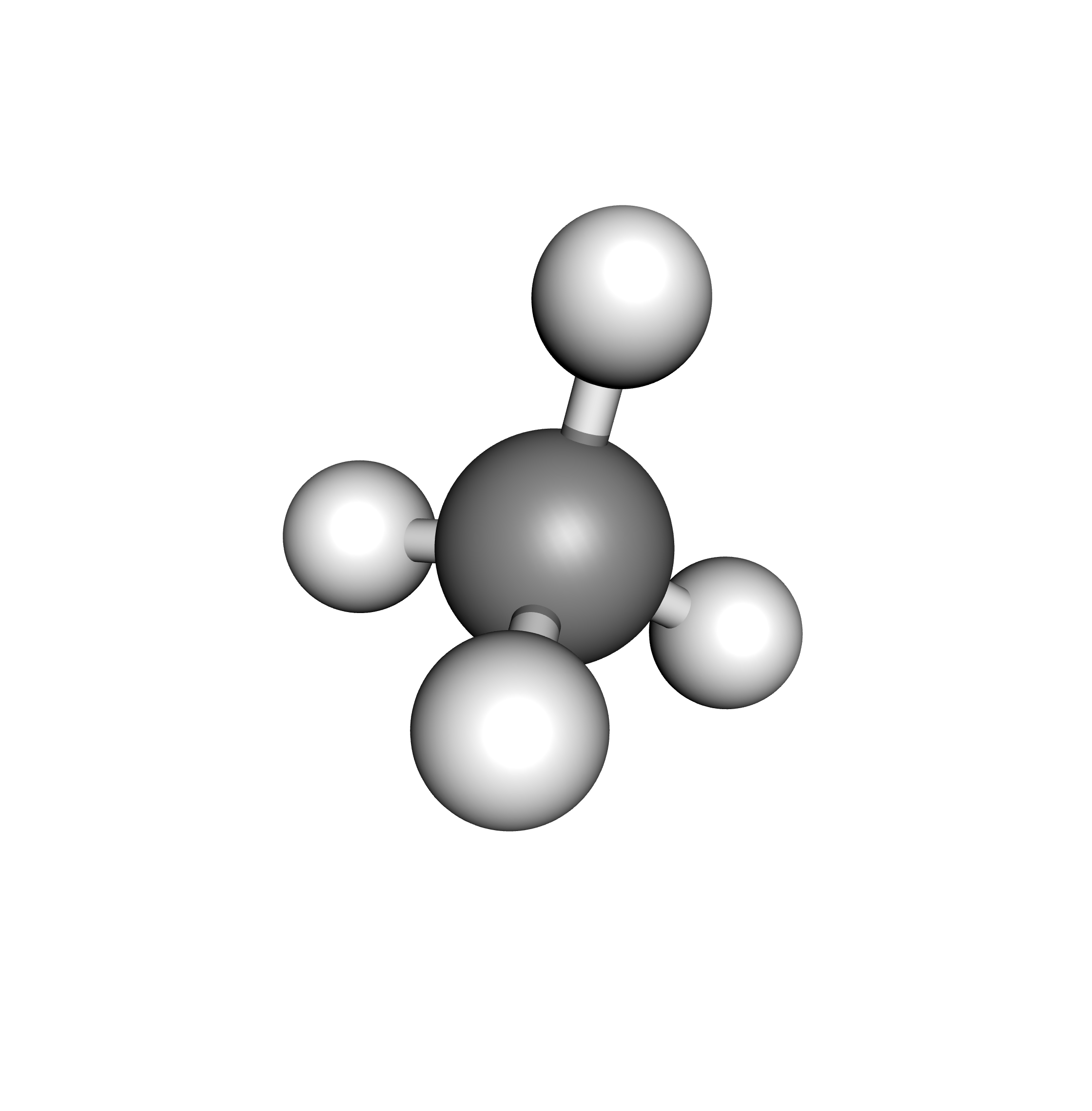
4 doublets liants
$\rightarrow$ l’atome central est au centre d’un tétraèdre
Exemple du méthane $\ce{CH4}$ :
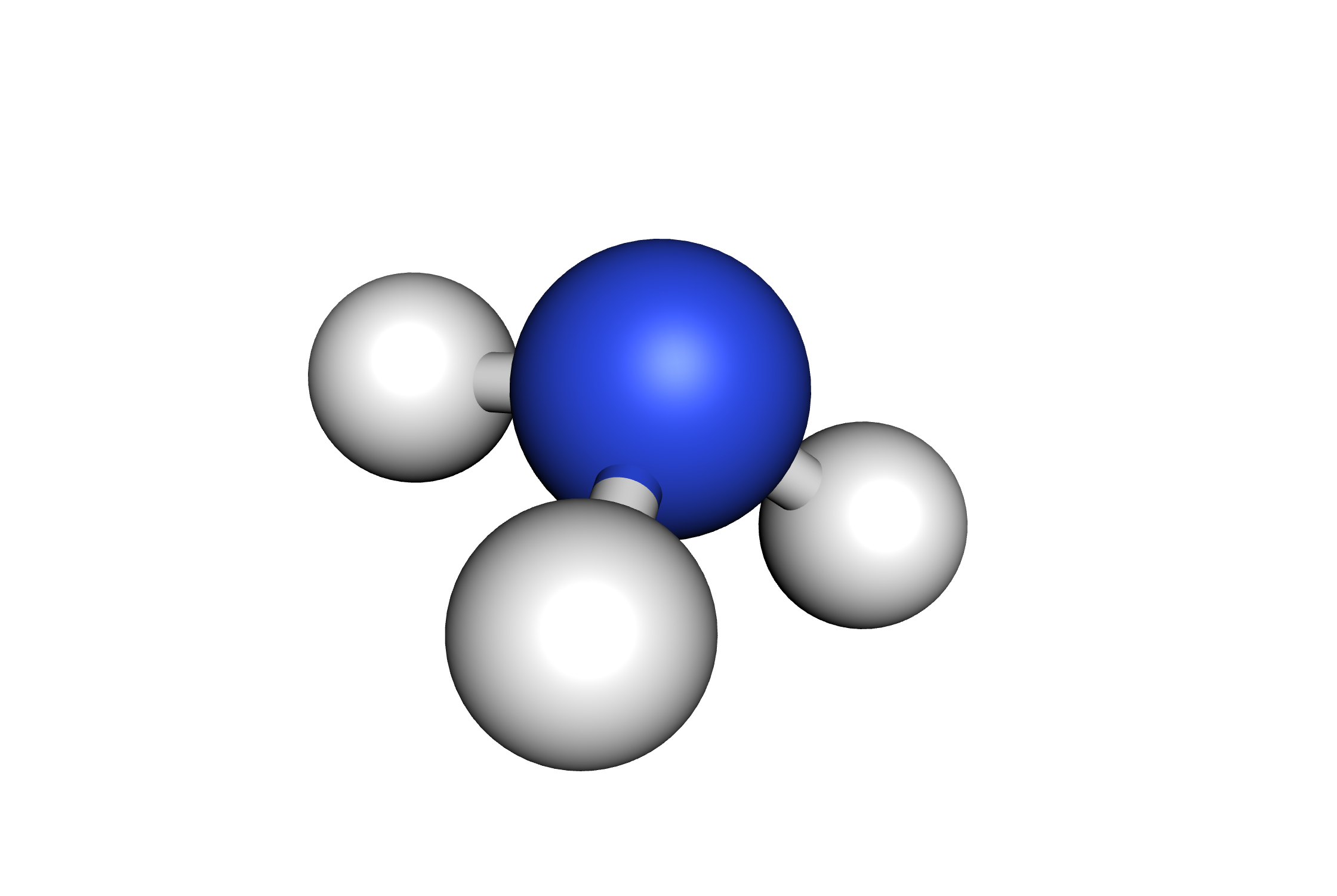
3 doublets liants, 1 non-liant
$\rightarrow$ l’atome central est au sommet
d’une pyramide à base triangulaire
Exemple de l’ammoniac $\ce{NH3}$ :
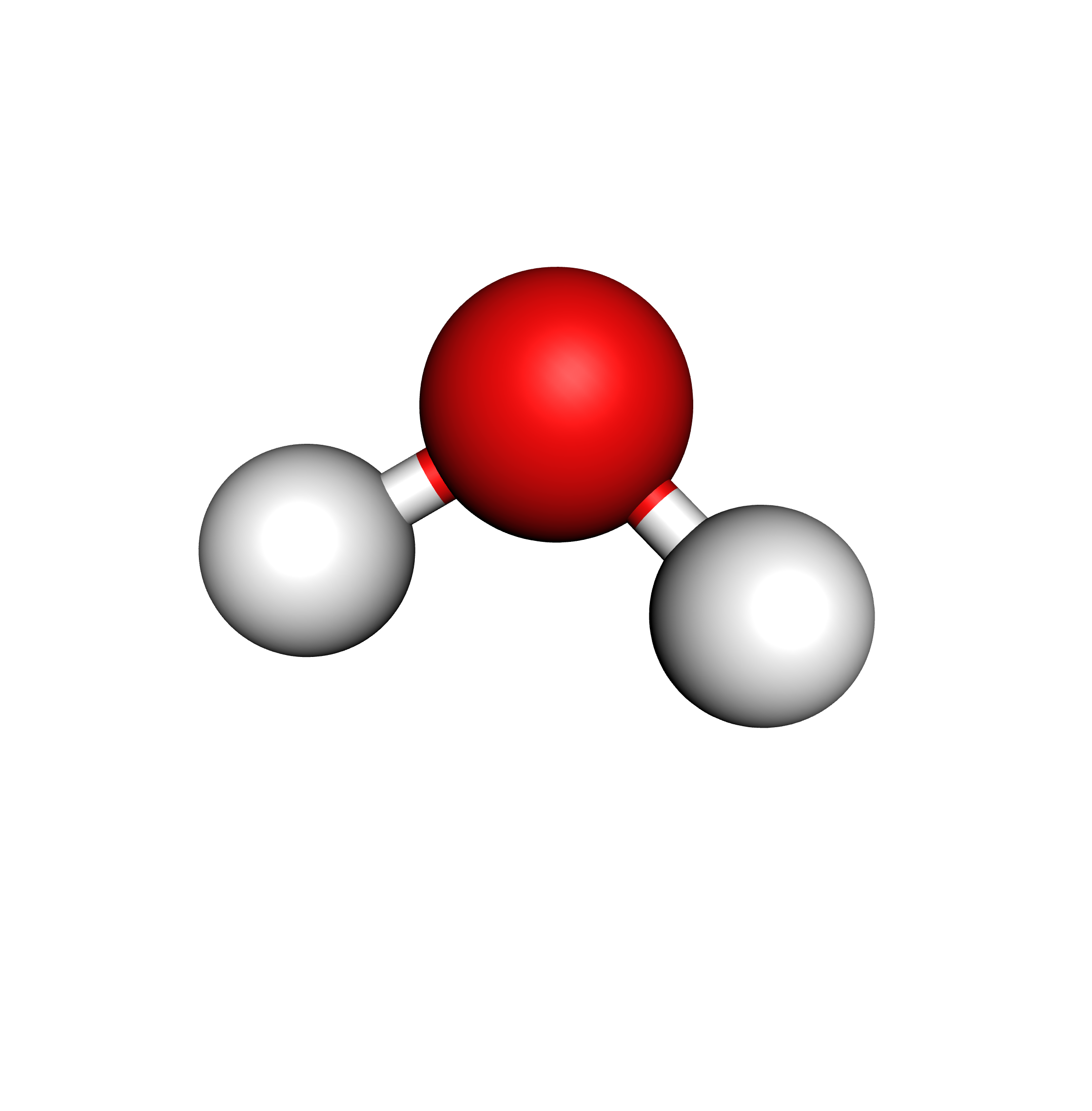
2 doublets liants, 2 non-liants
$\rightarrow$ géométrie coudée
Exemple de l’eau $\ce{H2O}$ :
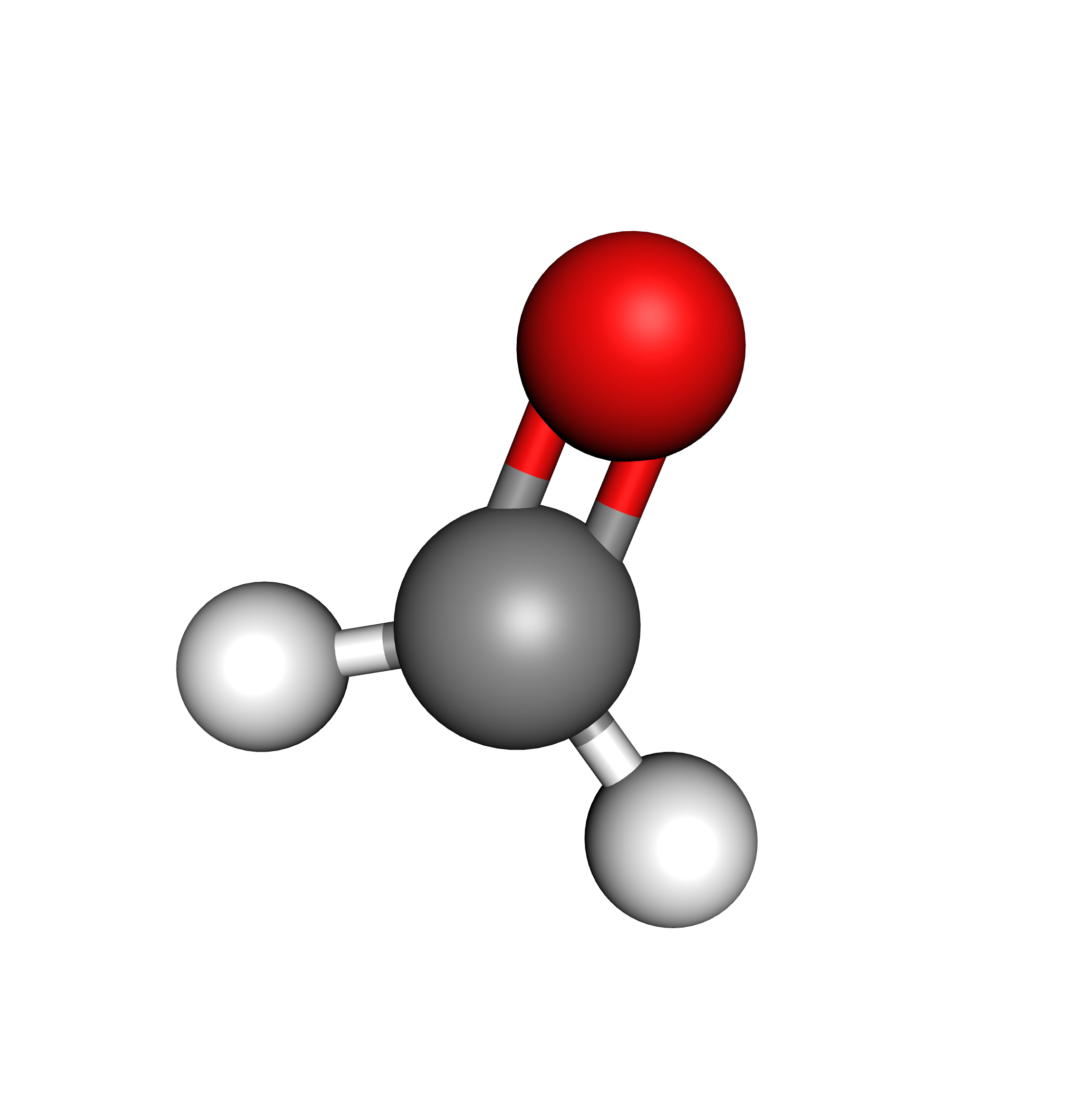
Une double liaison rend la molécule plane.
Une double liaison et deux liaisons simples
$\rightarrow$ géométrie triangulaire
Exemple : méthanal $\ce{CH2O}$ (formol)
deux doubles liaisons
$\rightarrow$ géométrie linéaire
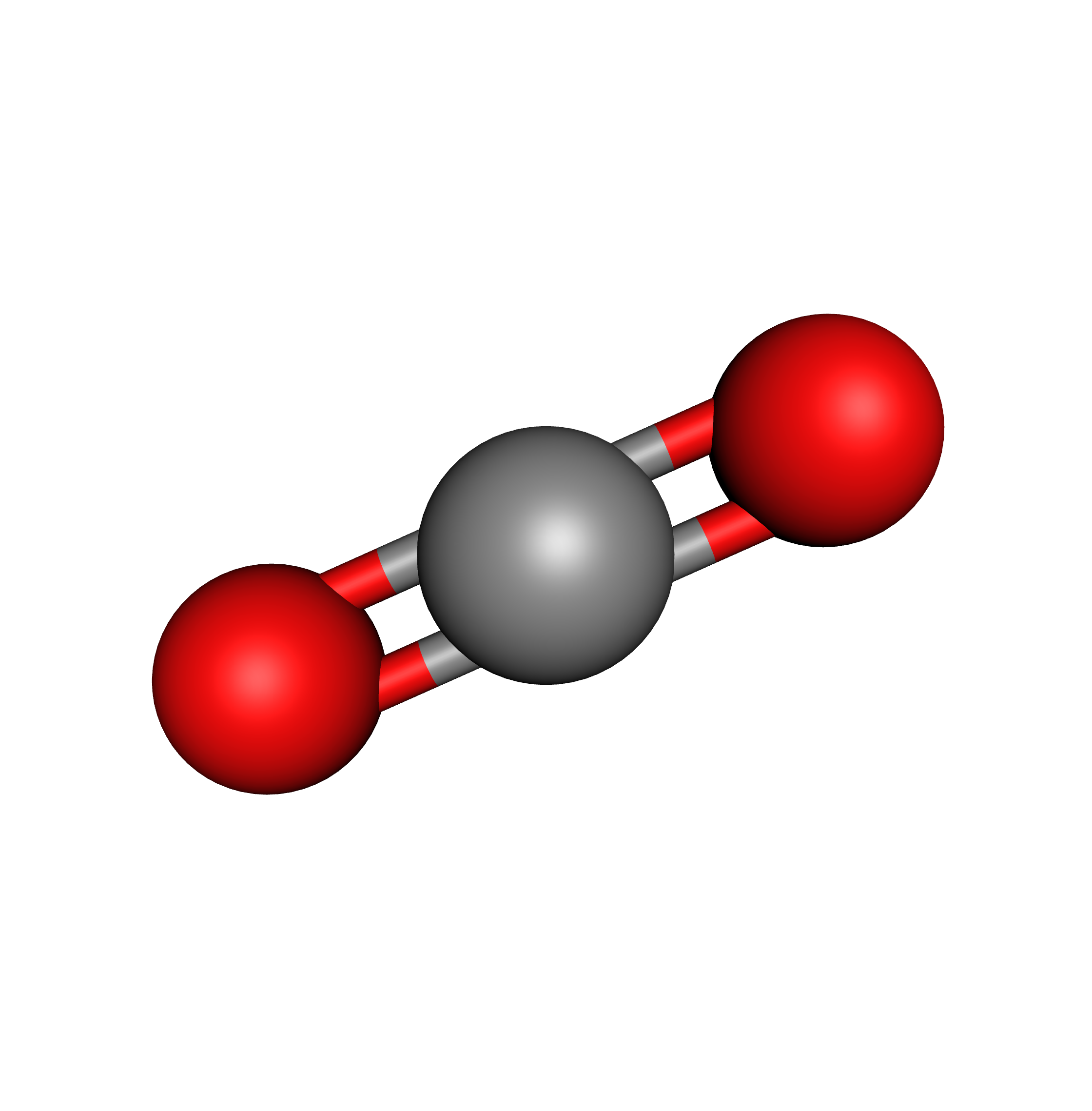
Exemple du $\ce{CO2}$ :
Polarité
d'un atome à attirer à lui le doublet
d'électrons d'une liaison chimique.
L’électronégativité augmente globalement
lorsqu’on avance sur une période (une ligne)
et lorsqu’on remonte une famille (une colonne).
L'élément le plus électronégatif est le fluor
et l'oxygène arrive juste derrière.
Le carbone et l'hydrogène
ont des électronégativité comparables.
La liaison entre deux atomes est :
- covalente apolaire si les deux atomes ont
une différence d'électronégativité faible
(comme entre $\ce{C}$ et $\ce{H}$).
- covalente polaire si les deux atomes ont
une différence d'électronégativité moyenne (comme entre $\ce{O}$ et $\ce{H}$).
- ionique lorsque la différence est si grande que l'atome le plus électronégatif s'est accaparé le doublet (comme entre $\ce{Na}$ et $\ce{Cl}$).
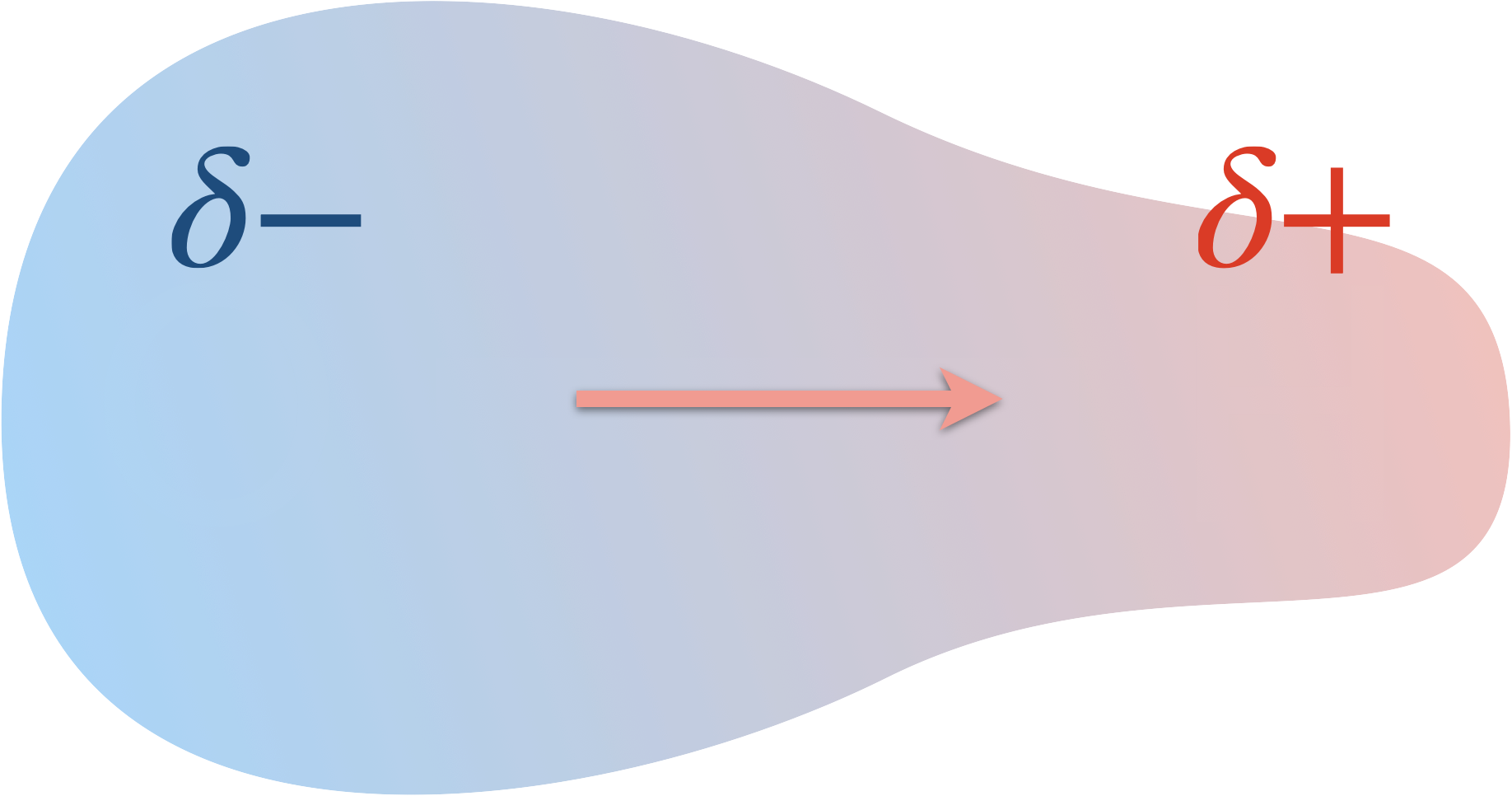
Dans une liaison covalente polarisée, les charges sont distribuées inégalement entre les deux atomes :
- il y a une charge partielle négative $\delta -$
au niveau de l'atome le plus électronégatif, - et une charge partielle positive $\delta +$
au niveau de l'atome le moins électronégatif
(le plus électropositif).
On a alors un dipole électrostatique (un pôle plus et un pôle moins) qui crée un champ électrostatique.
Exemple de liaison covalente polaire : la liaison $\ce{O-H}$
La double liaison $\ce{C=O}$, elle aussi, est polaire :
Expliquez alors pourquoi la molécule d’eau est polaire alors que la molécule de dioxyde de carbone
est apolaire.
Cela montre l’importance de la géométrie !
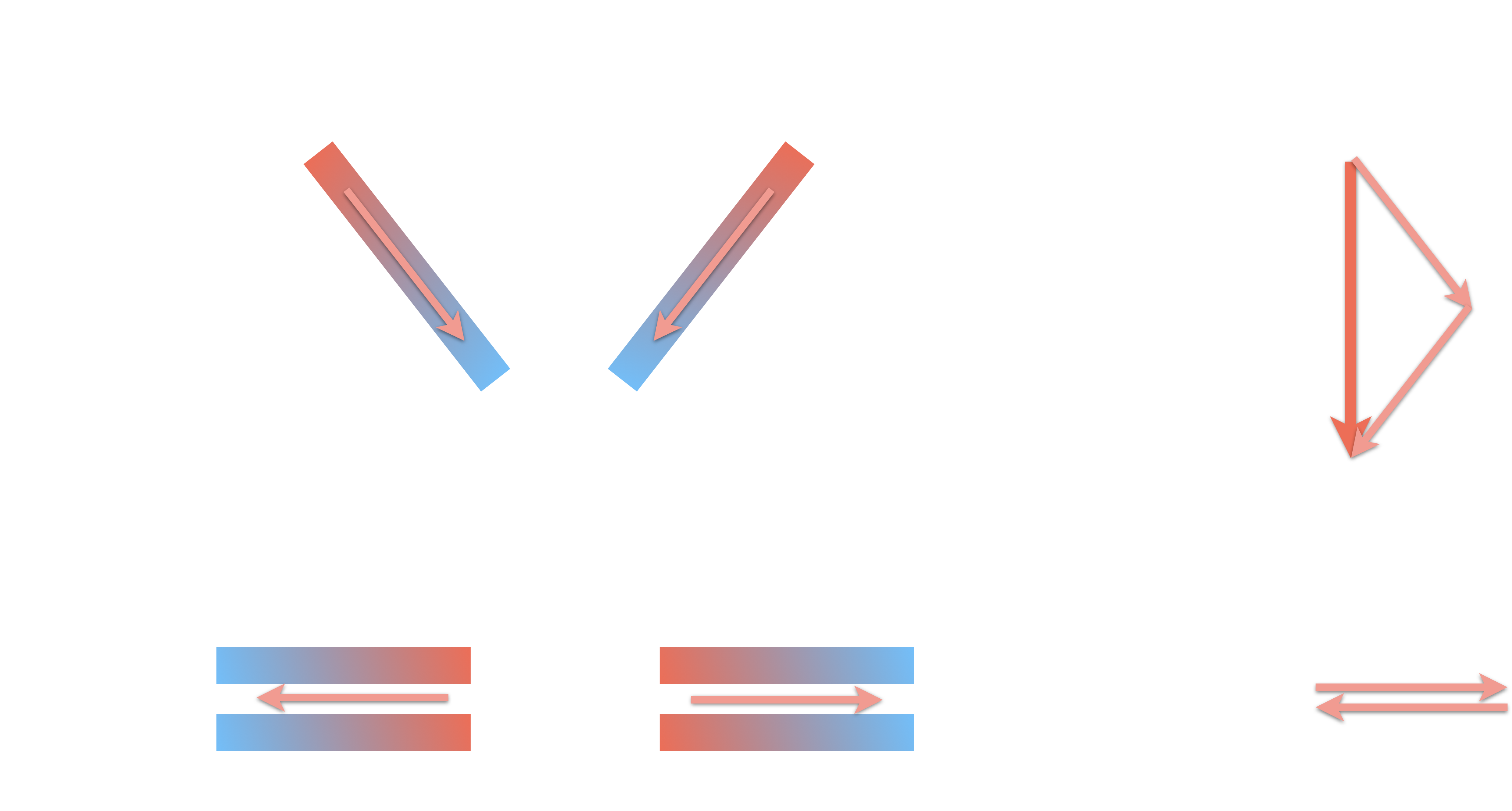
Si le barycentre (moyenne géométrique)
des charges partielles positives n’est pas confondu
avec celui des charges partielles négatives,
alors la molécules est polaire.
Moralité :
la présence de liaisons polarisées est une condition nécessaire mais non suffisante pour que
la molécule soit polaire ;
il faut en plus que la géométrie de la molécule n'entraîne pas la compensation des champs électrostatiques créés par ces liaisons.
Prévoir la polarité de la molécule de méthane $\ce{CH4}$
et celle d’ammoniac $\ce{NH3}$.
Point commun des molécules qui dévient le jet ?