Modèles ondulatoire et particulaire
de la lumière
Modèle ondulatoire
Indices expérimentaux de la nature
ondulatoire de la lumière :
- interférences
- diffraction
Bref… La lumière peut donc
se comporter comme une onde.
Il s’agit d’une onde électromagnétique de célérité $c=\pu{3,0E8 m*s-1}$ dans le vide.
Et comme toute onde, on peut donc lui associer une fréquence $\nu$ en (Hz) et une longueur d’onde $\lambda$ (en m) liées entre elles par :
-
La fréquence dépend / ne dépend pas
du milieu de propagation. -
La longueur d’onde dépend / ne dépend pas
du milieu de propagation.
-
La fréquence
dépend/ ne dépend pas
du milieu de propagation. -
La longueur d’onde dépend /
ne dépend pas
du milieu de propagation.
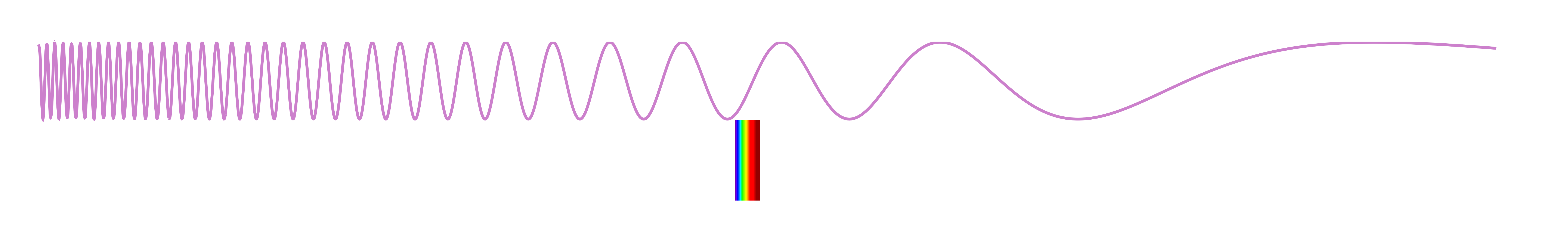
Le spectre électromagnétique
s’étend des ondes radio aux rayons gamma :
Modèle corpusculaire
Deux observations expérimentales ne trouvent pas d’explication dans le modèle ondulatoire :
- le rayonnement du corps noir
- l'effet photoélectrique
en généralisant l'idée de Planck au rayonnement
lui-même (et non plus seulement aux échanges).
La lumière serait constituée de petits paquets ;
les photons.
Le photon est une particule de lumière sans masse voyageant à $c$ qui transporte une énergie :
Unités :
- E en joule (J)
- $\nu$ en hertz (Hz)
- $h=\pu{6,63E-34 J*s}$
est la constante de Planck.
On peut lier énergie du photon et longueur d’onde :
Unités :
- E en joule (J)
- $\lambda$ en mètre (m)
- $h=\pu{6,63E-34 J*s}$
est la constante de Planck. - $c=$ $\pu{3,00E8 m*s^-1}$
est la célérité de la lumière.
Quantification des niveaux
d’énergie des atomes
Les niveaux d’énergie d’un atome sont quantifiés.
Le niveau le plus bas est appelé le fondamental et
les niveaux plus hauts en énergie sont dits excités.
Pour sauter d’un niveau d’énergie à l’autre,
l’électron doit absorber (s’il monte) ou émettre
(s’il descend) un photon dont l’énergie $h\nu$
correspond à la différence d’énergie
$\Delta E$ entre les deux niveaux :
Quelle est la couleur du photon émis
par la transition électronique ci-contre ?
Données :
- $\pu{1 eV}=\pu{1,60E-19 J}$
- $h=\pu{6,63E-34 Js}$
Les niveaux d’énergie quantifiés permettent d’expliquer les spectres discrets !
Pourquoi à votre avis le cornichon
présente le spectre du sodium ?
Spectre du Soleil vu depuis la Terre.