Acide/Base
Quel est le point commun de ces acides ?
Définition d’un acide
de Brönsted :
céder un ion hydrogène $\ce{H+}$
Définition d’une base
de Brönsted :
capter un ion hydrogène $\ce{H+}$
Couples acide-base
En cédant un proton, un acide $\color{#EE220C}\ce{AH}$
se transforme en sa base conjuguée $\color{#0076BA}\ce{A-}$ :
$\ce{\color{#EE220C}AH\color{black} –> \color{#0076BA}A- \color{black} + \color{#D41876}H+}$
Exemples :
$($$\ce{\color{#EE220C}{CH3COOH}}$$/$$\color{#0076BA}\ce{CH3COO-}$$)$
acide éthanoïque / ion éthanoate
$($$\ce{\color{#EE220C}{NH4+}}$$/$$\color{#0076BA}\ce{NH3}$$)$
ion ammonium / ammoniac
Les deux exemples précédents font partie
de deux familles chimiques ayant
des propriétés acidobasiques :
- acide carboxylique / ion carboxylate
- ion ammonium / amine
Autre exemple :
$($$\ce{\color{#EE220C}{H2CO3}}$$/$$\color{#0076BA}\ce{HCO3-}$$)$
acide carbonique / ion bicarbonate$($$\ce{\color{#EE220C}{HCO3-}}$$/$ $\color{#0076BA}\ce{CO3^2-}$$)$
ion bicarbonate / ion carbonateQue peut-on dire de l’acide carbonique $\ce{\color{#EE220C}H2CO3}$ ?
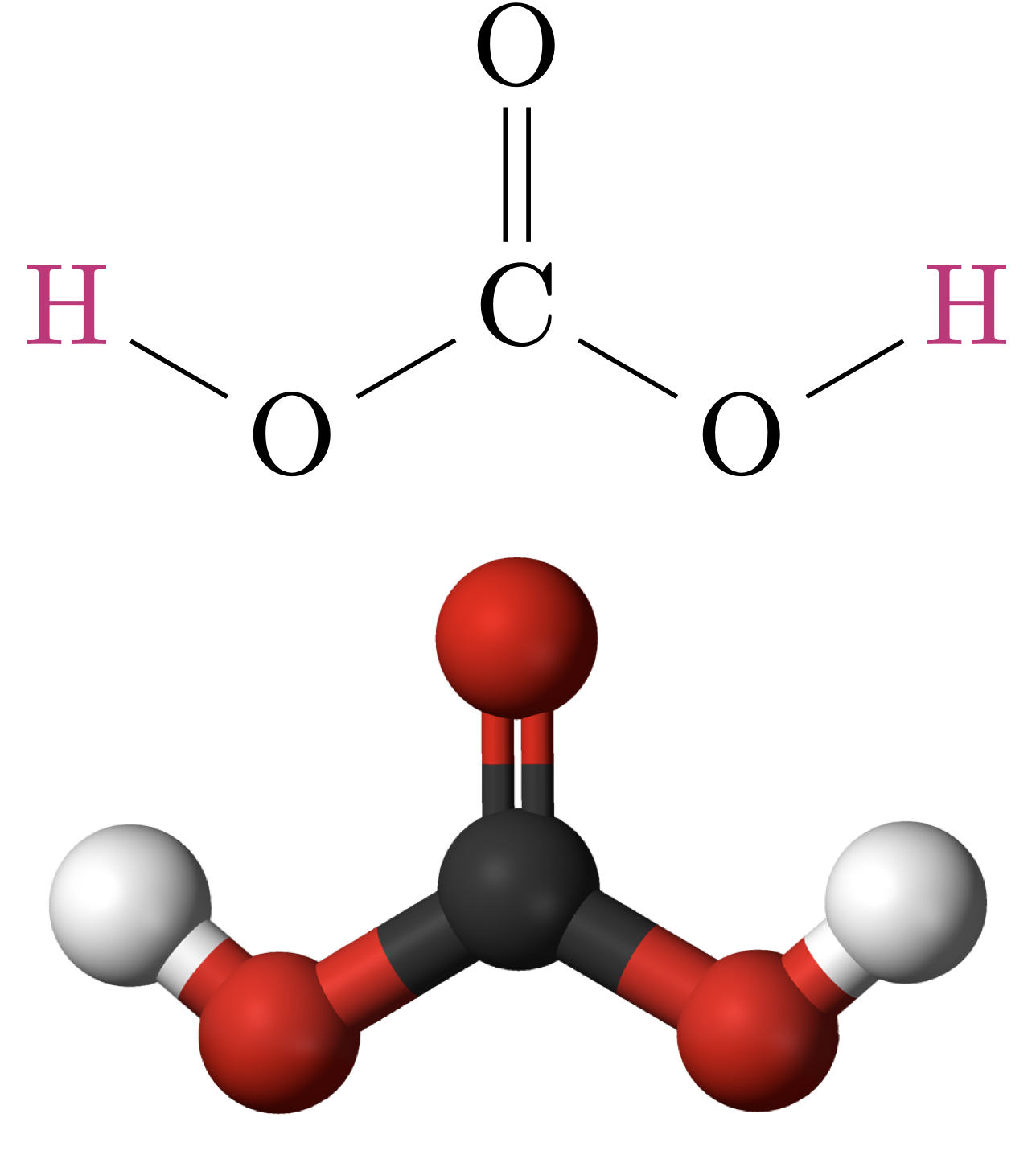
C'est un diacide !
Remarque
l’acide carbonique est créé par la solvatation
du dioxyde de carbone dans l’eau :
$$\ce{CO2 (aq) + H2O (\ell) -> H2CO3 (aq)}$$
Il est responsable de l'acidification des océans !
Et que peut-on dire de l’ion bicarbonate $\ce{HCO3-}$ ?
C'est à la fois la base de l'acide carbonique
et l'acide de l'ion carbonate.
On dit qu'il s'agit d'une espèce amphotère
ou d'un ampholyte.
Remarque
Le caractère amphotère de l’ion bicarbonate
lui permet de jouer un rôle de tampon.
Une solution tampon est une solution dont le pH varie peu lors de l'addition d'une petite quantité d'un acide, d'une base ou lors d'une légère dilution.
Dans le sang, l'ion bicarbonate participe
ainsi à la régulation du pH.
Dernier exemple :
$($$\ce{\color{#EE220C}{H3O+}}$$/$ $\color{#0076BA}\ce{H2O}$$)$
ion oxonium / eau$($$\ce{\color{#EE220C}{H2O}}$ $/$ $\color{#0076BA}\ce{HO-}$$)$
eau / ion hydroxydeQue peut-on dire de l’eau ?
L'eau est une espèce amphotère.
ou
L'eau est un ampholyte.
Réaction acido-basique
C’est la réaction entre l’acide d’un couple
et la base d’un autre couple.
Il y a alors échange d’un ion hydrogène $\color{#D41876}\ce{H+}$
donné par l’acide et capté par la base.
Soient les couples $\ce{({\color{#EE220C}A\color{#D41876}H}/\ce{A-})}$ et $\ce{(BH/{\ce{\color{#0076BA}B-}})}$,
la réaction entre $\ce{\color{#EE220}A\color{#D41876}H}$ et $\color{#0076BA}\ce{B-}$ s’écrit :
Exemple :
Écrire la réaction entre l’ammoniac $\color{#0076BA}\ce{NH_3}$
et l’acide ethanoïque $\ce{\color{#EE220C}CH3COO\color{#D41876}H}$.
Les deux couples acide-base mis en jeu :
$\ce{(NH4+/{\color{#0076BA}NH_3})}$ et $(\ce{\color{#EE220C}CH3COO\color{#D41876}H}/\ce{CH_3COO-})$
$\ce{{\color{#EE220C}CH_3COO\color{#D41876}H} +{\color{#0076BA}NH_3} -> CH_3COO- + NH4+}$
Exemple :
Écrire la réaction entre
l’ammoniac $\ce{NH_3}$ et l’eau $\ce{H2O}$.
Les trois couples acide-base mis en jeu : $\ce{(NH4+/NH_3)}$, $(\ce{H3O+}/\ce{H2O})$ et $(\ce{H2O}/\ce{OH-})$
Exemple :
Écrire la réaction entre l’acide éthanoïque $\ce{CH3COOH}$ et l’eau $\ce{H2O}$.
Le potentiel Hydrogène ($\text{pH}$)
Lorsqu’une espèce acide $\ce{AH}$ est ajoutée à une solution aqueuse, l’acide cède un ion hydrogène
à l’eau qui forme un ion oxonium $\ce{H3O+}$.
ajout de $\ce{AH}$ $\Rightarrow$ $\ce{[H3O+]}$➚
Et on sait aussi que :
ajout de $\ce{AH}$ $\Rightarrow$ $\text{pH}$➘
Le $\text{pH}$ est lié à la concentration
en ions oxonium $\ce{[H3O+]}$
Quand l’un augmente, l’autre diminue.
Définition du pH :
- le pH est sans unité
- $c^\circ = \pu{1 mol*L-1}$
(concentration standard)
Si $\ce{[H3O+]}=\pu{1,0E-8 mol * L-1}$,
$\text{pH}=$ $8,0$
Si $\ce{[H3O+]}=\pu{1,00E-12 mol * L-1}$,
$\text{pH}=$ $12,0$
Si $\ce{[H3O+]}=\pu{2,5E-2 mol * L-1}$,
$\text{pH}=$ $1,6$
Si $\ce{[H3O+]}=\pu{8,4E-13 mol * L-1}$,
$\text{pH}=$ $12,1$
Précision sur la précision :
on écrit généralement le pH
avec un seul chiffre après la virgule.
Pour obtenir $\ce{[H3O+]}$ à partir du $\text{pH}$ ?
Si $\text{pH}=7,0$
$\ce{[H3O+]}=$ $\pu{1,0E-7 mol * L-1}$
Si $\text{pH}=1,0$
$\ce{[H3O+]}=$ $\pu{1,0E-1 mol * L-1}$
Si $\text{pH}=9,8$
$\ce{[H3O+]}=$ $\pu{1,6E-10 mol * L-1}$
Si $\text{pH}=0,5$
$\ce{[H3O+]}=$ $\pu{3,2E-1 mol * L-1}$
Comment mesure-t-on le pH ?
pH-mètre
papier pH
bandelette test

Chou rouge
Hortensias
Petit exercice
On fait barboter $n=\pu{5,0E-3 mol}$
d’acide chlorhydrique $\ce{HC\ell (g)}$
dans $V=\pu{500 mL}$ d’eau.
La dissociation de l’acide chlorhydrique est totale et l’équation de la réaction est : $$\ce{HC\ell (g) + H2O (\ell) -> H3O+ (aq) + C\ell^- (aq)} $$
Que vaut le pH de la solution ?
Et si on dilue la solution 10 fois, que devient le pH ?