Force des acides
et des bases
Autoprotolyse de l’eau
L’eau est un ampholyte.
Les deux couples acide-base
auxquels l'eau appartient sont :
$$({\color{#88FA4E}\ce{H2O}}/{\color{#56C1FF}\ce{HO^-}})$$
$$({\color{#FF968D}\ce{H3O+}}/{\color{#88FA4E}\ce{H2O}})$$
L’eau peut donc réagir sur elle-même !
C’est la réaction d’autoprotolyse de l’eau.
Équation de la réaction :
$$\ce{{\color{#88FA4E}\ce{H2O}}(ℓ) + {\color{#88FA4E}\ce{H2O}}(ℓ) -> {\color{#FF968D}\ce{H3O+}}(aq) + {\color{#56C1FF}\ce{HO^-}}(aq)}$$
La constante d’équilibre de cette réaction, aussi appelée produit ionique de l’eau s’écrit :
À 25°C, $K_\mathrm{e}=\pu{1,0e-14}$,
d'où $\mathrm{p}K_\mathrm{e} =$ $-\log\left(K_\mathrm{e}\right)=$ $14$.
Si on connaît $K_\mathrm{e}$, la concentration en ions oxonium permet de déterminer celle en ions hydroxyde
et inversement.
Exemple :
Le pH d’une solution à 25°C est mesurée à 2,3.
Déterminer la concentration en ions oxonium
et en ions hydroxyde.
On peut déduire de $K_\mathrm{e}$ le pH
d’une solution acide, neutre ou basique.
- Si la solution est neutre
On a par définition :
$\ce{[{\color{#FF968D}\ce{H3O+}}]=[{\color{#56C1FF}\ce{HO^-}}]}$
Et comme $\displaystyle\frac{\ce{[{\color{#FF968D}\ce{H3O+}}}]\times[{\color{#56C1FF}\ce{HO^-}}]}{{C^\mathrm{o}}^2}={\color{#FFF056}K_\mathrm{e}}$
on obtient $\ce{[{\color{#FF968D}\ce{H3O+}}]}^2 = {\color{#FFF056}K_\mathrm{e}} \times {C^\mathrm{o}}^2 $
Finalement :
$\begin{aligned} \ce{[{\color{#FF968D}\ce{H3O+}}]} &= \sqrt{{\color{#FFF056}K_\mathrm{e}} \times {C^\mathrm{o}}^2}\\ &= \sqrt{{\color{#FFF056}K_\mathrm{e}}}\times {C^\mathrm{o}} \\ &= \pu{1,0e-7 mol*L-1} \end{aligned} $
$ \displaystyle\mathrm{pH} = \frac{1}{2}\mathrm{p}K_\mathrm{e} = 7,0 $
- Si la solution est acide
$\ce{[{\color{#FF968D}\ce{H3O+}}]>[{\color{#56C1FF}\ce{HO^-}}]}$
Et donc $\displaystyle\ce{[{\color{#FF968D}\ce{H3O+}}]}>\frac{{\color{#FFF056}K_\mathrm{e}}\times {C^\mathrm{o}}^2}{\ce{[{\color{#FF968D}\ce{H3O+}}]}}$
$\displaystyle \Rightarrow\ce{[{\color{#FF968D}\ce{H3O+}}]}^2>{\color{#FFF056}K_\mathrm{e}}\times {C^\mathrm{o}}^2$
$\displaystyle \Rightarrow\ce{[{\color{#FF968D}\ce{H3O+}}]}> \sqrt{{\color{#FFF056}K_\mathrm{e}}}\times {C^\mathrm{o}}$
d'où $\displaystyle \ce{[{\color{#FF968D}\ce{H3O+}}]}> \pu{1,0e-7 mol*L-1}$
Ou encore
$\displaystyle \mathrm{pH}<\frac{1}{2}{\color{#FFF056}\mathrm{p}K_\mathrm{e}}$
Soit $\displaystyle \mathrm{pH}<7,0$
- Si la solution est basique
$\ce{[{\color{#FF968D}\ce{H3O+}}]<[{\color{#56C1FF}\ce{HO^-}}]}$
$\displaystyle \Rightarrow \ce{[{\color{#FF968D}\ce{H3O+}}]}< \pu{1,0e-7 mol*L-1}$
Soit $\displaystyle \mathrm{pH}>7,0$
Acides forts et bases fortes
de manière quasi-totale avec l'eau.
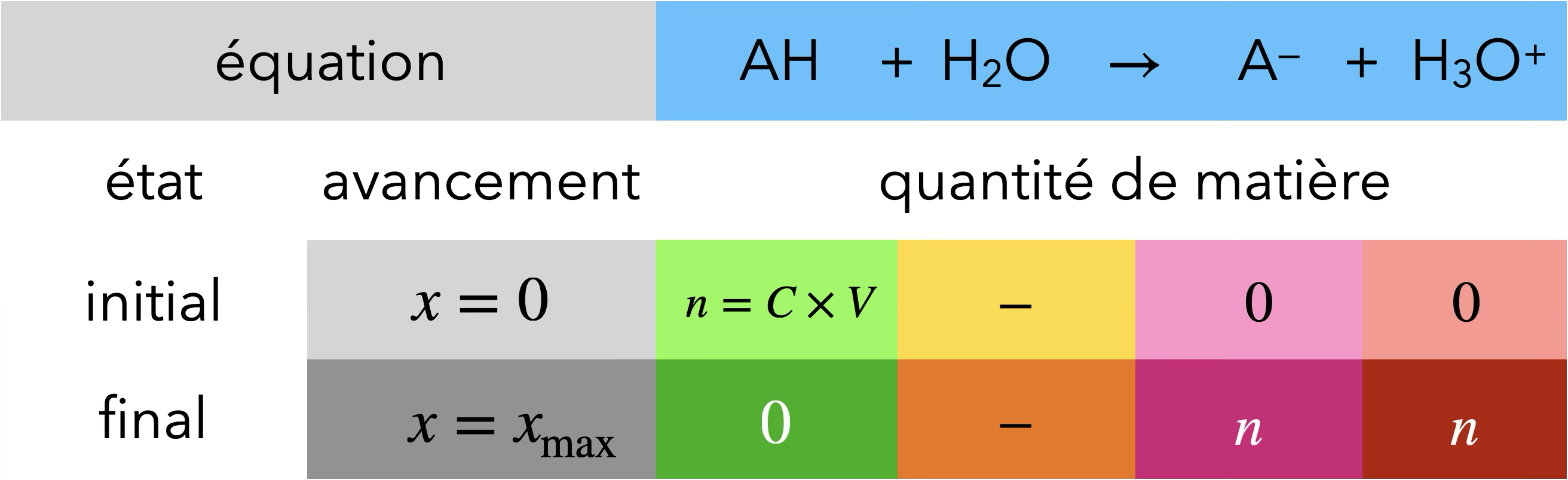
$\ce{{\color{#FF968D}AH} + H2O ->}$ $\ce{A- + H3O^+}$
Si $\ce{AH}$ est un acide fort
(où $\tau$ est le taux d'avancement de la réaction)
D’où ${\color{#FF968D}\ce{[H3O^+]}} = \ce{[AH]_0} = {\color{#FF968D}C}$
La concentration en ions oxonium en solution est
égale à la concentration apportée $C$ en acide.
$\Rightarrow\mathrm{pH}=$ $\displaystyle -\log\left(\frac{C}{C^\mathrm{o}}\right)$
${\color{#56C1FF}\ce{A^-}} \ce{+ H2O ->}$ $\ce{AH + HO^-}$
Si $\ce{A-}$ est une base forte, $\tau= 1$
D'où ${\color{#56C1FF}\ce{[HO^-]}} \ce{= [A^-]_0} = {\color{#56C1FF}C}$
la concentration en ions hydroxyde est égale
à la concentration apportée $C$ en base.
$\Rightarrow\mathrm{pH}=$ $\displaystyle 14 -\log\left(\frac{C}{C^\mathrm{o}}\right)$
Exemples d’acides forts :
- l'acide chlorhydrique $\ce{HC (g)}$
$\ce{HCℓ(g) + H2O(ℓ) -> H3O^+(aq) + Cℓ^-(aq)}$ - l'acide nitrique $\ce{HNO3(ℓ)}$
$\ce{HNO3(g) + H2O(ℓ) -> H3O^+(aq) + NO3^-(aq)}$
Exemple de base forte :
- l'hydroxyde de sodium ou soude $\ce{NaOH(s)}$
$\ce{NaOH(s) + H2O(ℓ) -> HO^-(aq) + Na^+(aq)}$
Acides faibles et bases faibles
La transformation chimique entre un acide faible
ou une base faible et l’eau n’est pas totale.
$\ce{{\color{#FF968D}AH} + H2O -> A- + H3O^+}$
Si $\ce{AH}$ est un acide faible
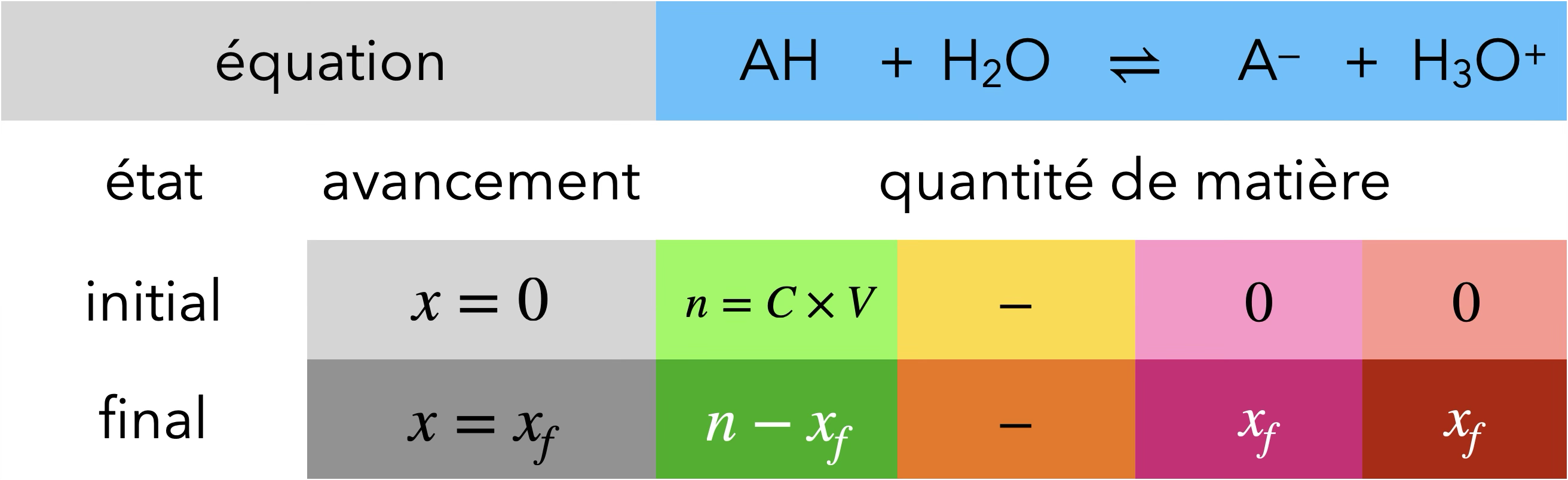
$$ \begin{aligned} x_f < n &\Rightarrow \ce{[H3O+] < C}\\ & \Rightarrow {\color{#FF968D} \mathrm{pH} > -\log\left(\frac{C}{C^\mathrm{o}}\right) } \end{aligned} $$
Le pH d'un acide faible dans l'eau est plus grand que celui d'un acide fort de même concentration apportée.
${\color{#56C1FF}\ce{A^-}}\ce{ + H2O -> AH + HO^-}$
Si $\ce{A-}$ est une base faible, $\tau < 1$
Le pH d'une base faible dans l'eau est
plus faible que celui d'une base forte
de même concentration apportée.
Exemple d’un acide faible :
- l'acide éthanoïque $\ce{CH3COOH(ℓ)}$ou acide acétique
(sa forme dissoute est simplement $\ce{CH3COOH(aq)}$)
$\ce{CH3COOH(ℓ) + H2O(ℓ) -> H3O^+(aq) + CH3COO^-(aq)}$
Sa base conjuguée est l'ion éthanoate.
Exemple d’une base faible :
- l'ammoniac $\ce{NH3(g)}$
(sa forme dissoute est simplement $\ce{NH3(aq)}$)
$\ce{NH3(g) + H2O(ℓ) -> HO^-(aq) + NH4^+(aq)}$
Son acide conjugué est l'ion ammonium.
Force d’un acide faible
ou d’une base faible
$$\ce{{\color{#FF968D}AH} + H2O -> A- + H3O^+}$$
La constante d’équilibre de la réaction d’un acide faible dans l’eau s’appelle constante d’acidité notée $K_\mathrm{A}$.
$K_\mathrm{A}$ caractérise un couple acide-base $({\color{#FF968D}\ce{AH}}/{\color{#56C1FF}\ce{A-}})$.
Par définition,
${\color{#FF968D}K_\mathrm{A}}=$ $\displaystyle\frac{\ce{[A-]_\mathrm{f} \times[H3O+]_\mathrm{f} }}{[{\color{#FF968D}\ce{AH}}]_\mathrm{f}\times C^\mathrm{o}}$
Pour comparer la force des acides faibles, ou la force des bases faibles, on compare leurs $K_\mathrm{A}$ ou plutôt leurs $\mathrm{p}K_\mathrm{A}$ qui permettent de manipuler des valeurs plus pratiques (généralement entre 0 et 14).
Plus la réaction d’un acide faible sur l’eau est avancée,
- plus $\tau$ est proche de 1
- plus $K_\mathrm{A}$ est grand
- plus $\mathrm{p}K_\mathrm{A}$ est faible
${\color{#56C1FF}\ce{A^-}}\ce{ + H2O -> AH + HO^-}$
Pour une base faible, la constante d’équilibre
de sa réaction avec l’eau s’écrit :
$$ \begin{aligned} {\color{#56C1FF}K_\mathrm{B}}&=\frac{\ce{[AH]\times[HO-]}}{[{\color{#56C1FF}\ce{A^-}}]\times C^\mathrm{o}}\\ &=\frac{\ce{[AH]}\times {\color{#FFF056}K_\mathrm{e}\times {C^\mathrm{o}}^2}}{[{\color{#56C1FF}\ce{A^-}}]\times C^\mathrm{o}\times {\color{#FFF056}\ce{[H3O+]}}}\\ &= \frac{\color{#FFF056}K_\mathrm{e}}{\color{#FF968D}K_\mathrm{A}} \end{aligned} $$
Plus la réaction d’une base faible sur l’eau est avancée,
- plus $\tau$ est proche de 1
- plus $K_\mathrm{B}$ est grand
- plus $K_\mathrm{A}$ est petit
- plus $\mathrm{p}K_\mathrm{A}$ est grand
Donc plus un acide faible est fort
(plus il réagit avec l’eau),
plus son $\mathrm{p}K_\mathrm{A}$ est faible.
À l'inverse,
plus une base faible est forte
(plus elle réagit avec l'eau),
plus son $\mathrm{p}K_\mathrm{A}$ est grand.
Pour le couple $({\color{#FF968D}\ce{H3O+}}/{\color{}\ce{H2O}})$, que vaut $K_\mathrm{A}$ ?
Et $\mathrm{p}K_\mathrm{A}$ ?
Pour le couple $({\color{}\ce{H2O}}/{\color{#56C1FF}\ce{HO-}})$, que vaut $K_\mathrm{A}$ ?
Et $\mathrm{p}K_\mathrm{A}$ ?
On classe les acides et les bases
sur une échelle de pKA.
$\ce{NH4+}$ est un acide plus faible / fort que $\ce{CH3COOH}$
$\ce{NH3}$ est une base plus faible / forte que $\ce{CH3COO-}$
Diagramme de distribution
La proportion à l’équilibre
d’un acide $r_\mathrm{AH}$ est le quotient :
$${\color{#FF968D} r_\mathrm{AH}}=\frac{\color{#FF968D} n_\mathrm{AH,f}}{{\color{#FF968D}{n_\mathrm{AH,f}}}+{\color{#56C1FF}n_\mathrm{A^-,f}}}$$
Et celle de sa base conjuguée :
$${\color{#56C1FF} r_\mathrm{A^-}}=\frac{\color{#56C1FF} n_\mathrm{A^-,f}}{{\color{#FF968D}{n_\mathrm{AH,f}}}+{\color{#56C1FF}n_\mathrm{A^-,f}}}$$
Dans un diagramme de distribution, on superpose les courbes donnant la proportion à l’équilibre en quantité d’un acide et de sa base conjuguée en fonction du pH.
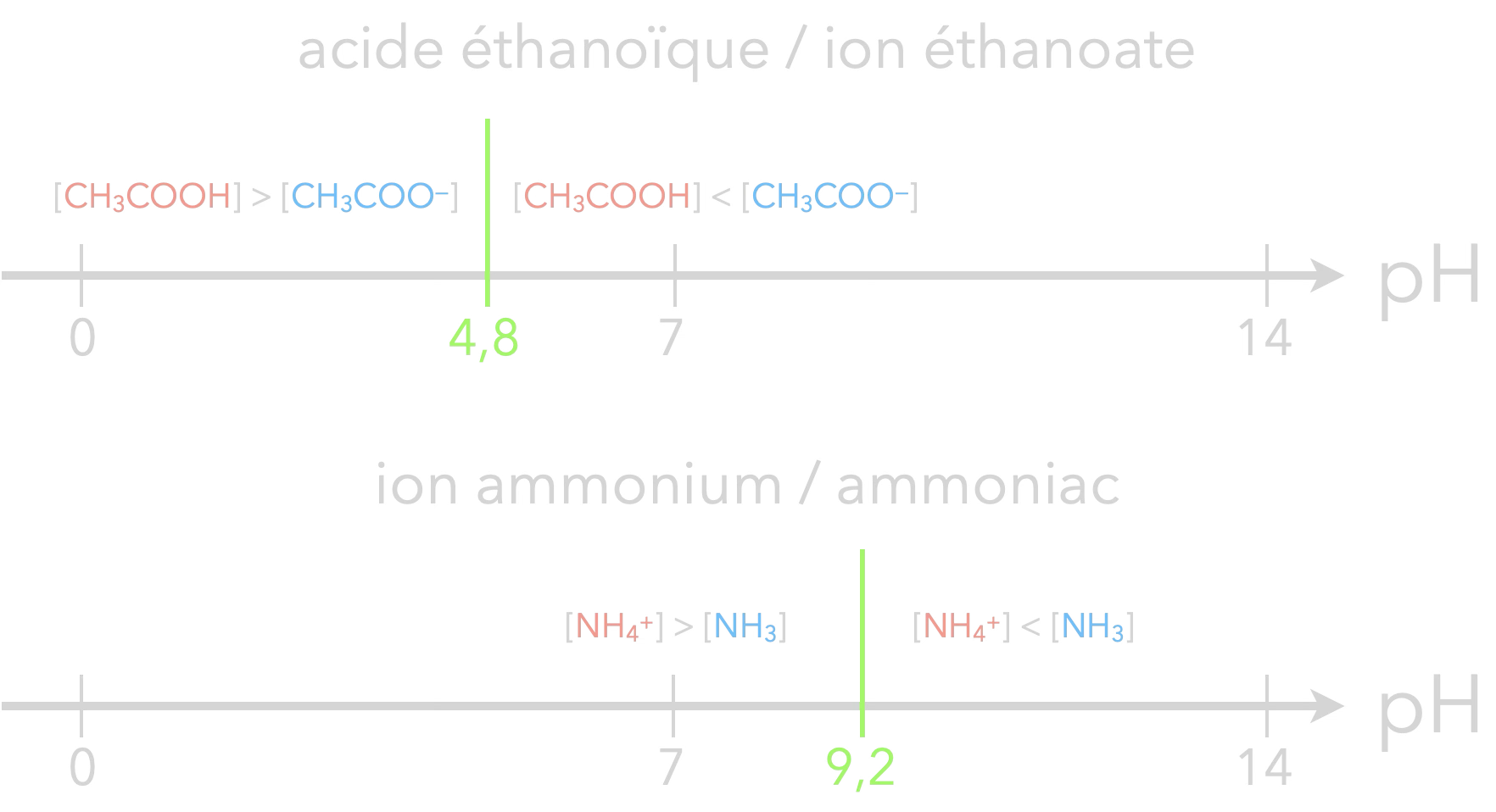
Diagramme de prédominance
Le diagramme de prédominance est une simplification du diagramme de distribution. On n’indique plus que l’espèce qui prédomine sur un axe de pH :
- pour $\mathrm{pH < pK_A}$, $\mathrm{{\color{#FF968D}[AH]}>{\color{#56C1FF}[A^-]}}$
- pour $\mathrm{pH = pK_A}$, $\mathrm{{\color{#FF968D}[AH]}={\color{#56C1FF}[A^-]}}$
- pour $\mathrm{pH > pK_A}$, $\mathrm{{\color{#FF968D}[AH]}<{\color{#56C1FF}[A^-]}}$
Exemples :
Rq :
L’acide d’un couple peut très bien dominé sa base conjuguée dans une solution aqueuse basique
et réciproquement, une base peut dominer
dans une solution acide !
Indicateur coloré
Un indicateur coloré est un couple acide-base
dont la forme acide et la forme basique
n’ont pas la même couleur.
La zone de virage d’un indicateur coloré
est la zone de pH où les formes acides et basique
sont en proportions similaires.
La couleur de l'indicateur coloré dans la zone de virage est alors un mélange des couleurs acide et basique.
La zone de virage intervient pour $\mathrm{pH}=$ $\mathrm{pK_A}$.
Les diagramme de prédominance permettent de caractériser efficacement un indicateur coloré.
Pour utiliser efficacement un indicateur coloré
lors d’un titrage ayant pour support une réaction
acide-base, il faut que la zone de virage
contienne le pH à l’équivalence pHE.
Exemple : choisir un indicateur coloré
adapté au titrage ci-après.
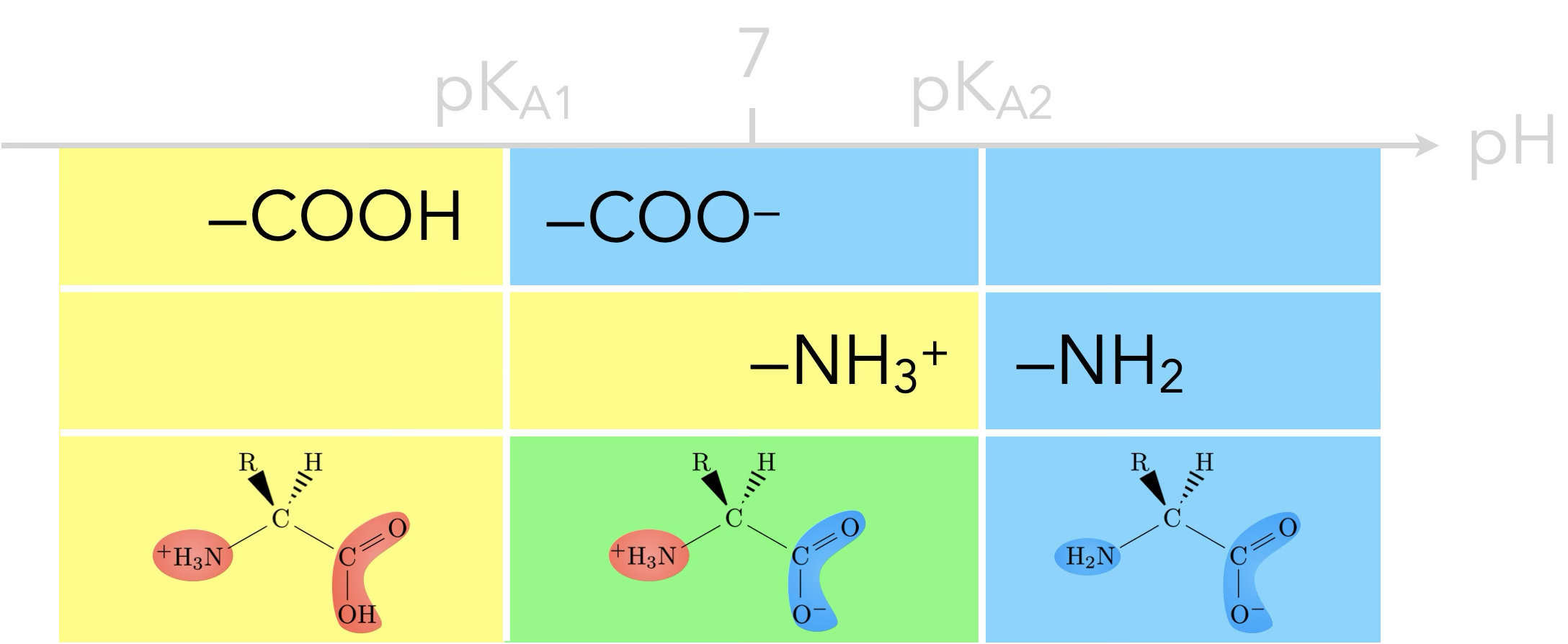
Acide $\alpha$-aminé
Qu’ont de communs ces acides α-aminés ?
- un groupe carboxyle
- un groupe amine
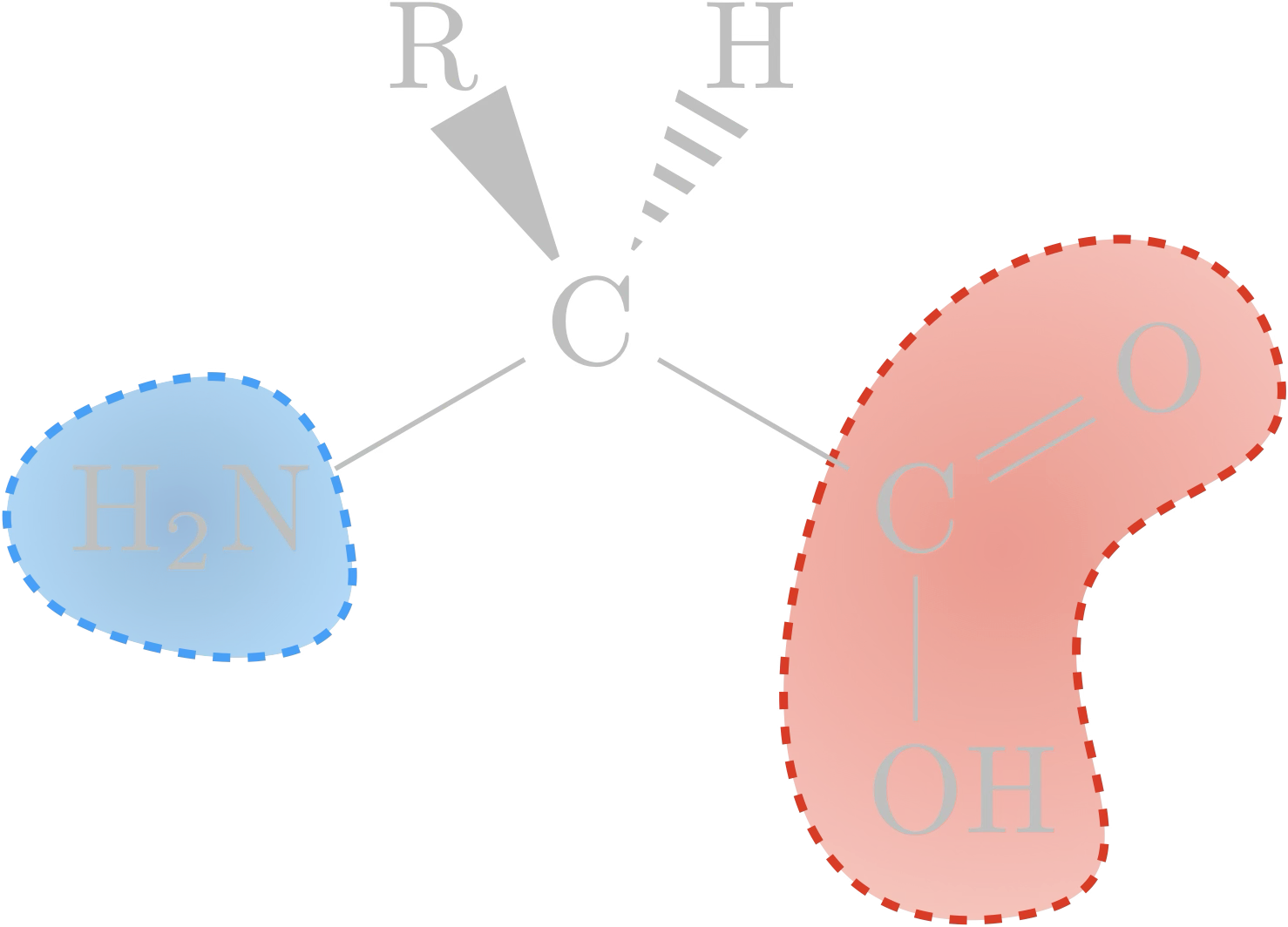
Les acides aminés sont donc des amphotères car ils interviennent à la fois dans le couple acide-base acide carboxylique ($\ce{-COOH}$) / ion carboxylate ($\ce{-COO^-}$) de constante d’acidité $\mathrm{K_{A1}}$ et le couple ion ammonium
($\ce{-NH3^+}$) / amine ($\ce{-NH2}$) de constante $\mathrm{K_{A2}}$,
avec $\mathrm{pK_{A1}<pK_{A2}}$.
Diagramme de prédominance d’un acide aminé :
Solution tampon

Solution pour laquelle un ajout modéré
d’acide ou de base modifie peu le pH.
De même, le pH varie peu lors d’une dilution.
Une telle solution peut exister grâce à l’"effet tampon" qui consiste en l’absorption ou la libération d’ion hydrogène par les espèces présentes dans la solution.
On rencontre cet effet dès lors qu'un acide $\color{#FF968D}\ce{AH}$
et sa base conjuguée $\color{#56C1FF}\ce{A-}$ sont présents en solution.
Si pour une raison quelconque, la concentration en ions oxonium varie en solution, cela va déplacer
l’équilibre entre $\color{#FF968D}\ce{AH}$ et $\color{#56C1FF}\ce{A-}$ de manière
à compenser cette variation.
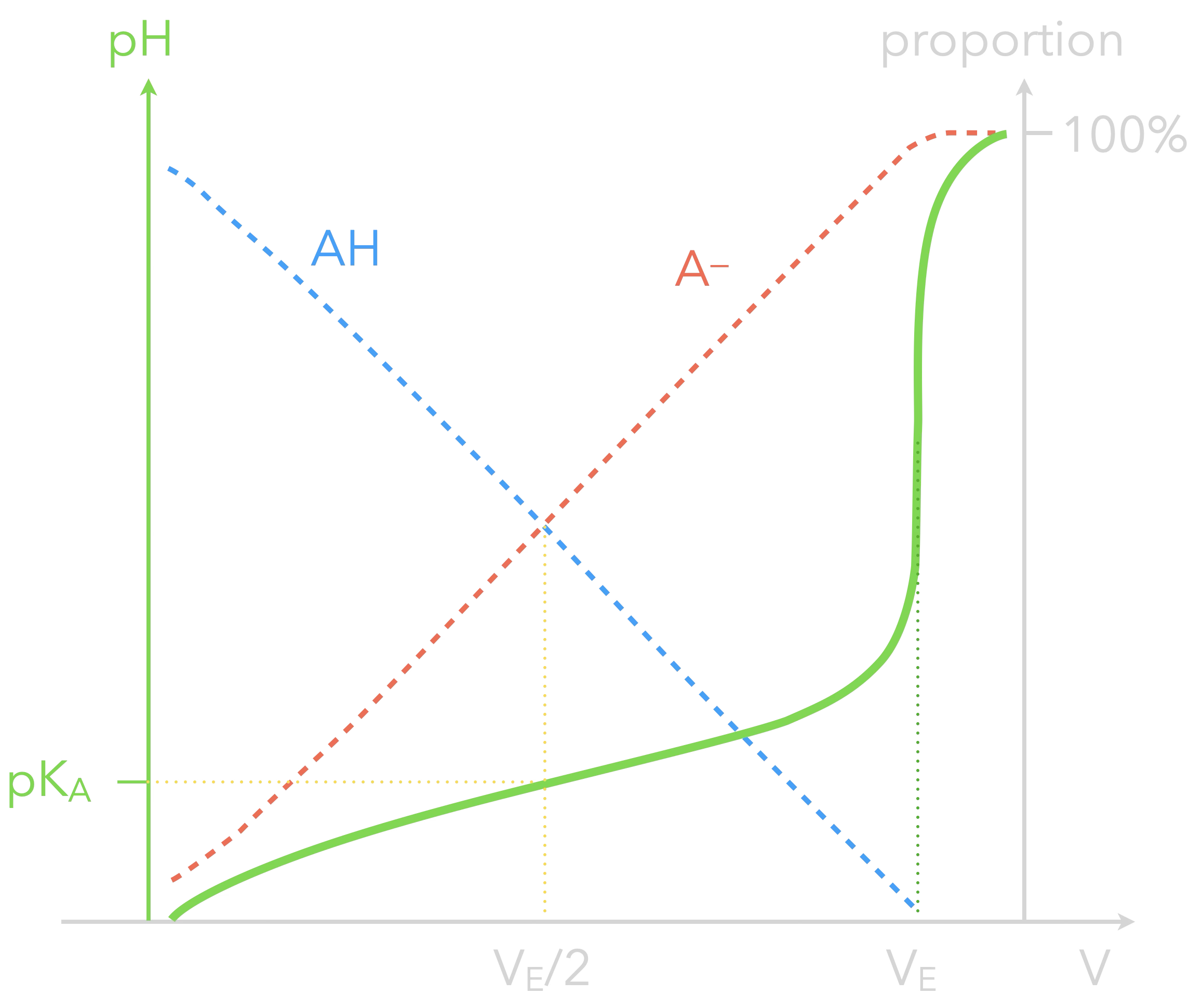
Cette compensation (et donc l'effet tampon)
est maximale quand ${\color{#FF968D}\ce{[AH]}}={\color{#56C1FF}\ce{[A-]}}$,
c'est-à-dire lorsque $\mathrm{pH}=$ $\mathrm{pK_A}$.
Les courbes de titrage pH-métrique confirment que les plus faibles variations de pH ont lieu dans cette zone :
Le sang est une solution tampon !
C’est le couple acide carbonique $\ce{H2CO3}$ /
ion bicarbonate (ou hydrogénocarbonate) $\ce{HCO3-}$
qui est le principal responsable du maintien du pH
du sang entre 7,35 et 7,45.
Au-delà de la petite fenêtre, des acidoses ou alcaloses se développent rapidement et conduisent à la mort.
💀
Application
retour sur l’exercice du chaulage du lac acide

Pourquoi utilise-t-on du carbonate de calcium
sachant que l’ion carbonate est une base faible
(couple $(\ce{HCO3-}/\ce{CO3^2-}$) de $\mathrm{p}K_\mathrm{A}=10,3$)
plutôt qu’une base forte comme
l’hydroxyde de sodium ?
Un titrage pH-métrique d’un litre de solution à pH 5,5 représentant l’eau du lac est réalisé avec une solution d’ions carbonates avec $\ce{[CO3^2-]=\pu{1,00 mmol*L-1}}$, puis par une solution d’ions hydroxyde avec $\ce{[HO^-]=\pu{1,00 mmol*L-1}}$.
La concentration de ces solutions
titrantes est-elle adaptée ?