Synthèse organique
Rappels : étapes d’une synthèse
1 – Transformation des réactifs
On utilise le plus souvent un montage à reflux
qui permet d'accélérer la transformation tout en évitant les pertes de matière dans les vapeurs.
2 – Isolement du produit synthétisé
- Si le produit est soluble :
On réalise un extraction liquide-liquide.
+ lavage
+ séchage
+ élimination du solvant
- Si le produit est insoluble
(formation d'un précipité) :
On réalise une extraction solide-liquide.
Pour cela, on utilise une filtration sous vide
(qui permet d'accélérer le processus)
En fonction de la phase que l'on
souhaite récupérer, on parle :
- de filtration pour la phase liquide,
- d'essorage pour la phase solide.
3 – Purification du produit synthétisé
- Si le produit est solide :
on peut opérer une recristallisation.
- Si le produit est liquide :
on peut cette fois-ci se lancer
dans une distillation fractionnée ou une chromatographie sur colonne.
4 – Identification du produit synthétisé
et vérification de sa pureté
- Mesure de la température de fusion
au banc Kofler (pour un solide) - Mesure de la température d'ébullition
(pour un liquide) - Mesure de l'indice optique au
réfractomètre (pour un liquide) - Spectrographie infrarouge
- Chromatographie sur couche mince
(CCM)
Optimisation d’une étape de synthèse
optimiser la vitesse
Pour augmenter la vitesse de la 1re étape
d’une synthèse ( transformation des réactifs),
on peut jouer sur les facteurs cinétiques que sont :
- la température :
dans la plupart des cas, une augmentation
de la température accélère la réaction
et c'est pour cela qu'on utilise
un montage à reflux.
- la concentration des réactifs :
une augmentation de la concentration des réactifs
rend généralement la transformation plus rapide.
On peut aussi citer :
- la pression s'il s'agit d'une transformation
en phase gazeuse. - l'état poreux ou divisé (poudre) d'un solide dans le cas d'une synthèse hétérogène car on augmente ainsi la surface de l'interface entre les réactifs.
Enfin, on peut augmenter
la vitesse de la transformation
en utilisant un catalyseur adapté.
optimiser le rendement
On peut augmenter le rendement
de la transformation en :
- introduisant un réactif en excès,
- éliminant un produit du mélange réactionnel.
⚠️ La température ne joue pas sur le rendement !
Dans les deux cas, l’idée est
de diminuer le quotient de réaction $Q_r$.
Cela a pour conséquence
d'écarter le mélange de l'équilibre.
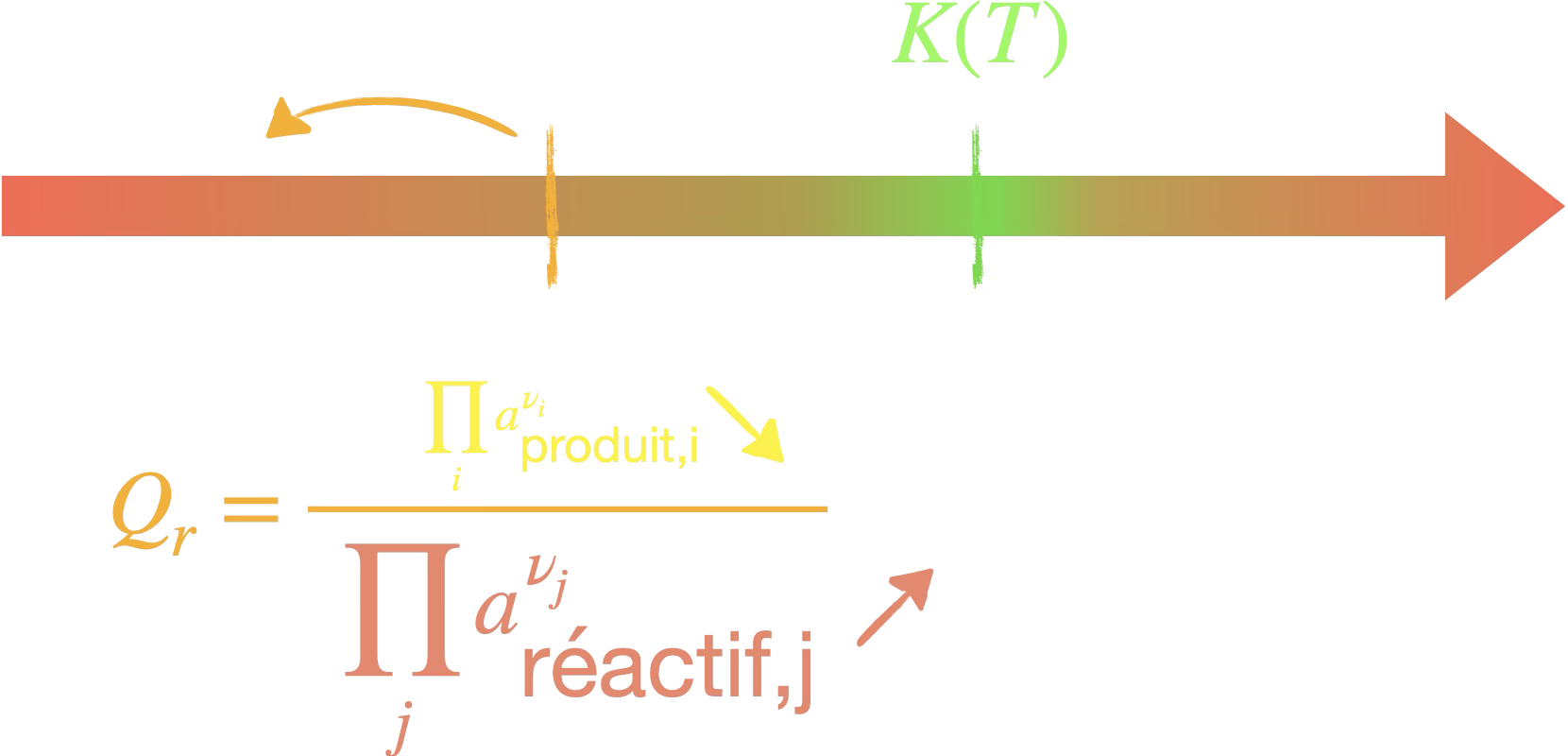
Par conséquent :
- $x_\mathrm{f}$ $\nearrow$
- $n_{\mathrm{produit},f}$ $\nearrow$
- $\eta = \frac{m_\mathrm{exp}}{m_\mathrm{max}}=\frac{n_\mathrm{exp}}{n_\mathrm{max}}$ $\nearrow$
On a déplacé l'équilibre.
Dans le cas d’une estérification où l’eau est un produit non soluble avec le solvant du milieu réactionnel,
on peut utiliser un appareil de Dean Stark.
Il permet de retirer au fur et à mesure l'eau du milieu réactionnel et d'améliorer ainsi le rendement.
Classification des réactions
Une synthèse peut mettre en œuvre un des 5 grands types de réaction suivant
(et parfois, une réaction
peut appartenir à deux types à la fois).
1 – Réaction d’oxydoréduction
- Échange d'électrons
- L'oxydant d'un couple oxydoréducteur
$\ce{({\color{#FF968D}Ox_1}/Red_1)}$ réagit avec le réducteur
d'un autre couple $\ce{(Ox_2/{\color{#56C1FF}Red_2})}$.
Exemple :
Oxydation de l’alcool benzylique
en acide benzoïque
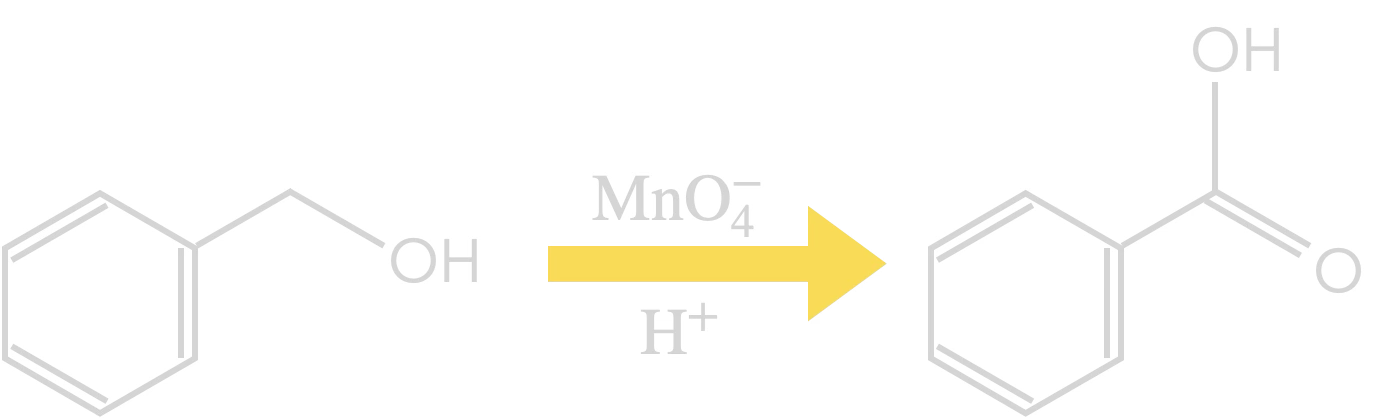
Rq : cette notation correspond à un schéma de transformation et non à une équation de réaction.
2 – Réaction acide-base
- Échange d'ion hydrogène
- L'acide d'un couple acide-base
$\ce{({\color{#FF968D}AH_1}/A_1^-)}$ réagit avec la base
d'un autre couple $\ce{(AH_2/{\color{#56C1FF}A_2^-})}$.
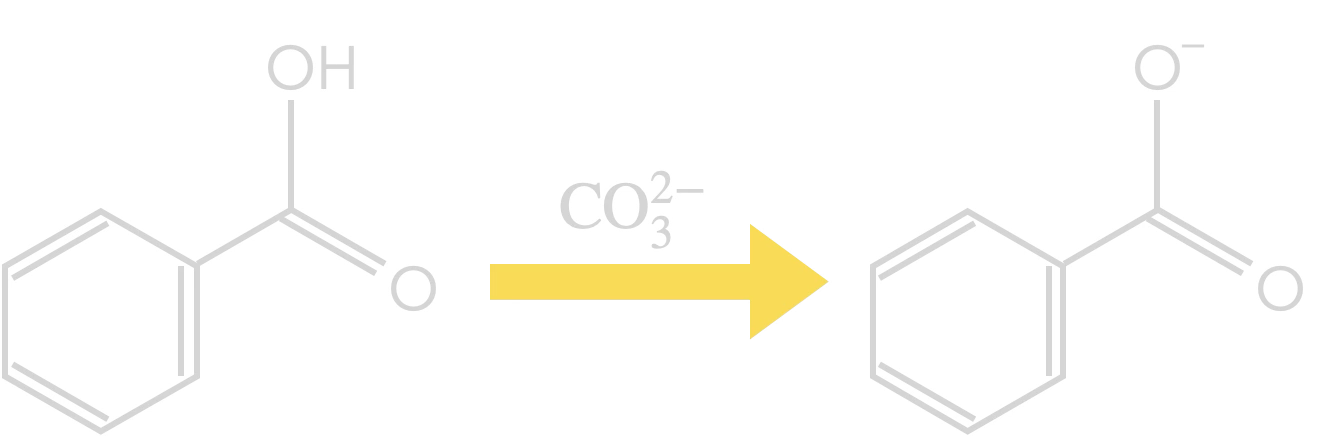
Exemple :
Transformation de l’acide benzoïque
en ion benzoate
3 – Réaction de substitution
Réaction au cours de laquelle un atome ou groupe d’atomes, lié à un carbone par une liaison simple, est remplacé par un autre atome ou groupe d’atomes :
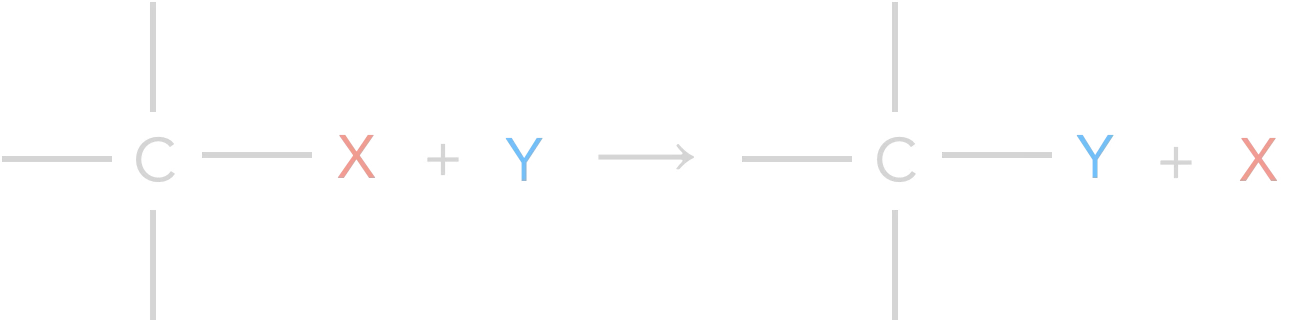
Rq : il y a autant de produits que de réactifs.
Exemple :
Transformation du 2-chloro-2-méthylpropane
en 2-méthylpropan-2-ol

4 – Réaction d’addition
Réaction au cours de laquelle un atome ou groupe d’atomes est ajouté sur une molécule possédant au moins une liaison multiple (double ou triple).
Rq : il y a moins de produits que de réactifs.
Exemple :
Hydrogénation de l’éthène :

5 – Réaction d’élimination
Réaction au cours de laquelle un atome ou groupe d’atomes est retiré sur une molécule conduisant à la formation d’une liaison multiple (double ou triple).
Rq : il y a plus de produits que de réactifs.
Exemple :
Déshydratation du 2-méthylpropan-2-ol :

Quel est l'autre produit (la molécule éliminée) ?
Ces 5 grands types de réaction peuvent
modifier un groupe caractéristique (et ainsi
changer la famille fonctionnelle d’une molécule)
et/ou modifier la chaîne carbonée !
Stratégie de synthèse multi-étapes
Synthétiser une molécule cible à partir
d’un précurseur nécessite souvent plusieurs étapes.
Pour déterminer la meilleure stratégie de synthèse,
on s'aide de banques de réactions qui regroupent les informations sur la réactivité des espèces organiques de différentes familles fonctionnelles en spécifiant
les conditions expérimentales dans lesquelles
les espèces réagissent ou ne réagissent pas.
Lorsqu’une espèce chimique appartient à plusieurs familles fonctionnelles réagissant dans les mêmes conditions expérimentales, il est parfois nécessaire de mettre en place une stratégie de synthèse appelée protection-transformation-déprotection
afin de synthétiser le produit désiré.
Exemple :
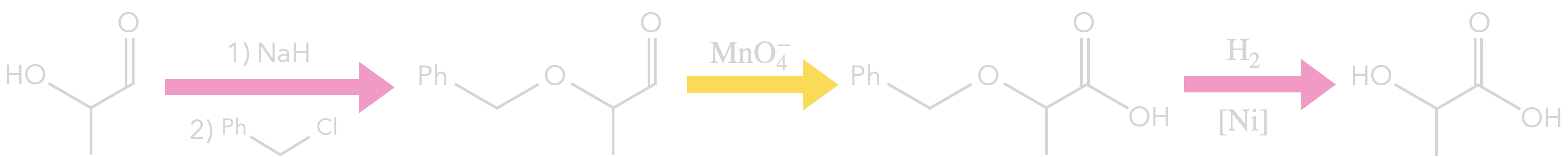
Supposons que l’on veuille former l’acide lactique (acide 2-hydroxypropanoïque) à partir
du 2-hydroxypropanal.

On peut penser à une oxydation.
Mais problème : une banque de réaction nous indique qu'une oxydation par l'ion permanganate transforme bien l'aldéhyde en acide carboxylique mais aussi
l'alcool en cétone et ça on veut éviter...

Il faut protéger la fonction alcool.
Voilà une stratégie possible :
Réaction de polymérisation
Lors d’une réaction de polymérisation,
de nombreux monomères réagissent
entre eux pour former un polymère.
Exemple :
Un acide carboxylique réagit avec un alcool en milieu acide pour former un ester (et de l’eau).
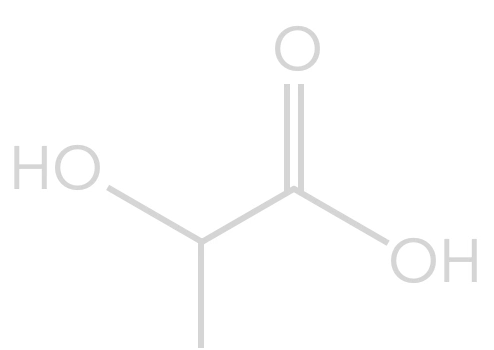
Or que peut-on dire de l'acide lactique ?
Il peut donc réagir avec lui-même en milieu acide !
On obtient l’acide polylactique.
Biosourcé (amidon de maïs) et biodégradable, le PLA est la première alternative naturelle au polyéthylène.
