Titrages
Les titrages sont des méthodes de dosage (détermination d’une quantité de matière inconnue) destructive utilisant une transformation chimique.
La réaction support d’un titrage doit être :
- totale
- rapide
- unique
Rq :
en première, la réaction support du titrage
était une
Montage :
La détermination de la quantité de matière du réactif titré repose sur le répérage de l’équivalence.
Rq :
En première, le repérage de l’équivalence
se fait par suivi colorimétrique.
- Avant l'équivalence : le titrant est limitant
- À l'équivalence : il y a changement de réactif limitant
- Après l'équivalence : le titré est limitant
Supposons que la réaction support du titrage est :
$$\ce{a A + b B -> \ldots}$$
où A est le réactif titré et B est le réactif titrant.
Comment évoluent les quantités de matière
dans le mélange réactionnel en fonction
du volume de titrant ajouté ?
À l’équivalence, le mélange est en
proportions stœchiométriques :
En terminale, on ajoute les réactions acide-base
comme support de titrage et deux types de suivi :
- pH-métrique
- conductimétrique
Titrage pH-métrique
La réaction support du titrage est une réaction acide-base et le suivi est pH-métrique (on relève le pH
en fonction du volume de titrant ajouté).
Le repérage de l’équivalence se fait après coup
(on ne s’arrête pas à l’équivalence).
Le passage par l'équivalence correspond à
un saut de pH sur la courbe $\mathrm{pH}=f(V_B)$ obtenue.
Deux méthodes permettent de
repérer précisément $V_E$ :
- la méthode de la dérivée
- la méthode des tangentes
Méthode de la dérivée
La dérivée de $\mathrm{pH}(V_B)$ passe par un maximum
au niveau du saut (point d’inflexion).
Méthode des tangentes
Titrage conductimétrique
Comme son nom l’indique, un tel titrage
est suivi par conductimétrie.
Principe :
Si les conductivités du titrant et du titré sont différentes, l’équivalence sera repérable par une rupture de pente dans la courbe $\sigma=f(V_B)$.
Méthode pour déterminer l’équivalence :
On trace les deux droites obtenues en excluant
les points trop près de la rupture. Les coordonnées
du point d’intersection donne le volume équivalent
et la conductivité à l’équivalence.
Exemple d’une courbe donnée à l’exercice
“Eau de Quinton” tombé en 2025
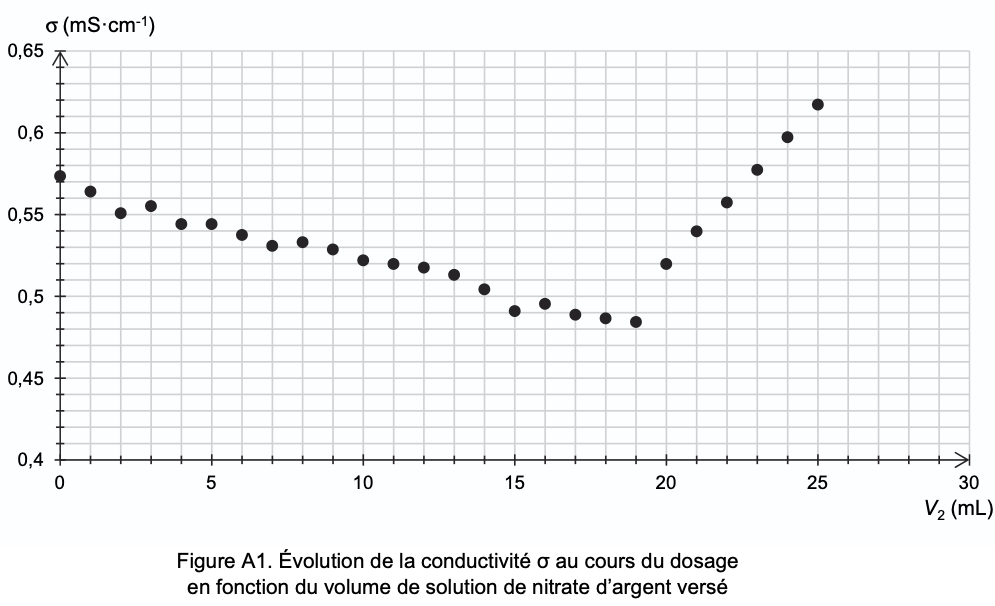
⚠️
On ajoute de l’eau à la solution titrée pour atténuer l’effet de la dilution due à l’ajout du volume de titrant.
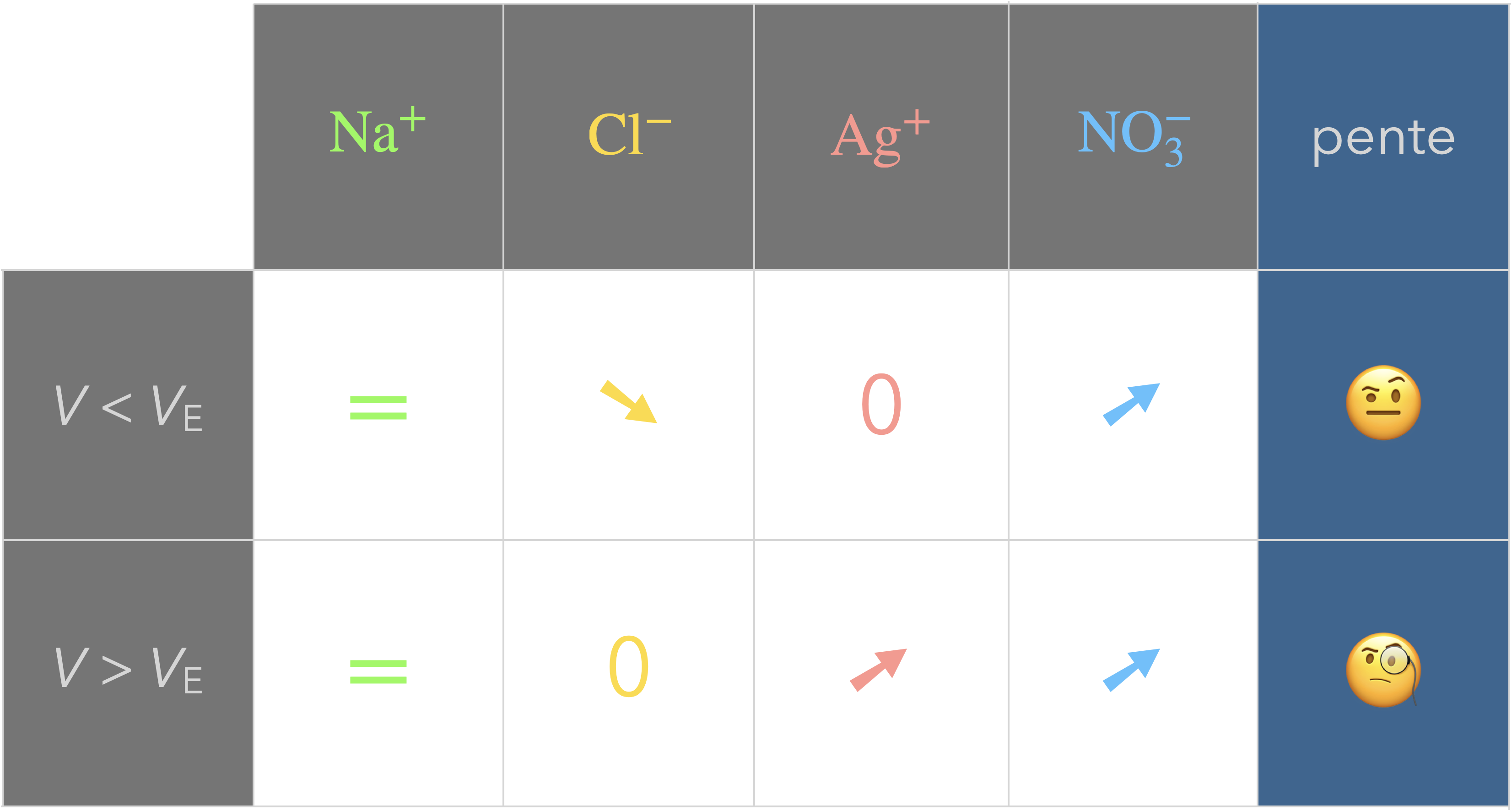
Exemple du titrage d’une solution
de chlorure de sodium $\ce{(Na+ + Cl^-)}$
par une solution de nitrate d’argent $\ce{(Ag+ + NO3^-)}$.
Données :
- $\lambda_\ce{Na+}=\pu{5,0 mS*m^2*mol-1}$
- $\lambda_\ce{Cl-}=\pu{7,6 mS*m^2*mol-1}$
- $\lambda_\ce{Ag+}=\pu{6,2 mS*m^2*mol-1}$
- $\lambda_\ce{NO3^-}=\pu{7,1 mS*m^2*mol-1}$
Prévoir la courbe de titrage obtenue.
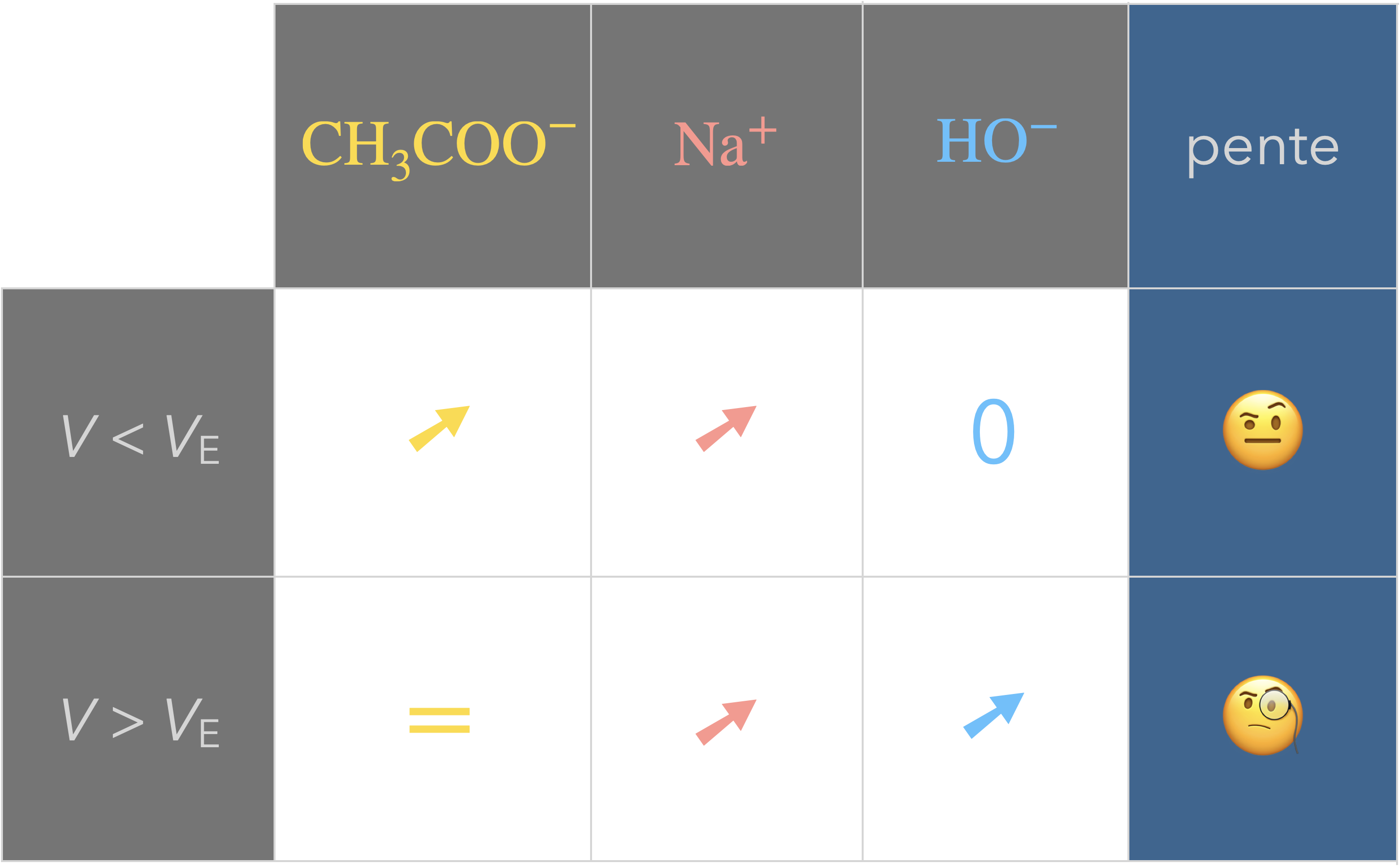
Exemple du titrage d’une solution
d’acide éthanoïque $\ce{CH3COOH (aq)}$
par une solution d’hydroxyde de sodium $\ce{(Na+ + HO^-)}$.
Données :
- $\lambda_\ce{Na+}=\pu{5,0 mS*m^2*mol-1}$
- $\lambda_\ce{HO-}=\pu{7,6 mS*m^2*mol-1}$
- $\lambda_\ce{CH3COO-}=\pu{4,1 mS*m^2*mol-1}$
Prévoir la courbe de titrage obtenue.
Densité
d’une solution
et titre massique
Densité $d$ d’une solution :
Unité ?
Le titre massique $w$ d’un soluté est le quotient de la masse de soluté apporté par la masse de solution :
Unité ?
On exprime souvent le titre en pourcentage.
On l’appelle d’ailleurs parfois
pourcentage massique
mais il peut aussi être
appelé teneur massique.